什么是蛋白质
蛋白质(protein)是由氨基酸(amino acid)为单位,通过肽键连接而成的一类高分子含氮化合物,是生命活动的物质基础。
- 蛋清遇酸生成白色絮状沉淀
- 蛋清加热变成白色胶状。
- 蛋白质是构成生物体的基本成份
- 分布广:所有器官、组织、细胞都含有蛋白质;
- 含量高:生物体含量最丰富的生物大分子。人体:45%
- 某些组织例如脾、肺及横纹肌等高达80%。
- 蛋白质是功能多样
- 包括催化、免疫、血液凝固、基因表达调控、肌肉收缩、运输、代谢调节等。
- 蛋白后分解供能
蛋白质的分类
- 依据蛋白质的外形分:球状蛋白质、纤维状蛋白质
- 球状蛋白:溶解形较好,大多数蛋白质属于这一类,蛋白质分子形状的长短轴之比小于10
- 纤维蛋白:可溶性和不溶性的纤维状蛋白质,蛋白质分子形状的长短轴之比大于10
- 依据蛋白质的组分分:简单蛋白(单纯蛋白质)、结合蛋白
- 简单蛋白(单纯蛋白质):分子中只含氨基酸的蛋白质
- 结合蛋白:分子中除了蛋白质部分还有非蛋白质的部分(其中非蛋白质部分称为蛋白质辅基)
- 按生物功能分:活性蛋白、非活性蛋白
按营养价值分:完全蛋白质、不完全蛋白质(含有的必需氨基酸种类不全)
角蛋白:角蛋白广泛存在于皮肤和皮肤的衍生物,如毛发,鳞等。角蛋白的分子中主要通过alpha-螺旋构成的蛋白质和二硫键组成的。
蛋白质的化学组成
元素:C 50-55%, H 6-7%, O 19-24%, N 13-19% , S 0-4%
微量的P、Fe、Cu、I、Zn、Mn
半胱氨酸和甲硫氨酸可以形成二硫键
特点:各种蛋白质的N含量恒定,平均16%,即每mg N 对应6.25mg蛋白质
100g样品的蛋白质含量=蛋白氮×6.25(凯氏定氮法)
基本结构单位是氨基酸
氨基酸是组成蛋白质的基本单位
- 通过脱水缩合形成肽键(酰胺键)
- 甘氨酸(Gly) alpha-氨基酸
- 脯氨酸(Pro) L-alpha-亚氨基酸
- 绝大多数人体必需氨基酸为L-alpha-氨基酸,除上述两种以外
天然氨基酸
- 天然氨基酸主要是L-alpha-氨基酸,但不是所有的
- 体内也存在若干不参与蛋白质合成但具有重要生理作用的L-alpha-氨基酸
氨基酸的分类
氨基酸可以根据侧链结构和理化性质进行分类,根据R基团不同的性质,有:
1. 中性氨基酸—— 侧链基团在中性溶液中不发生解离,因而不带电荷的氨基酸。可分为:
a) 极性氨基酸:Cys, Ser, Thr, Asn, Gln, Tyr,Trp(表层,易溶于水)
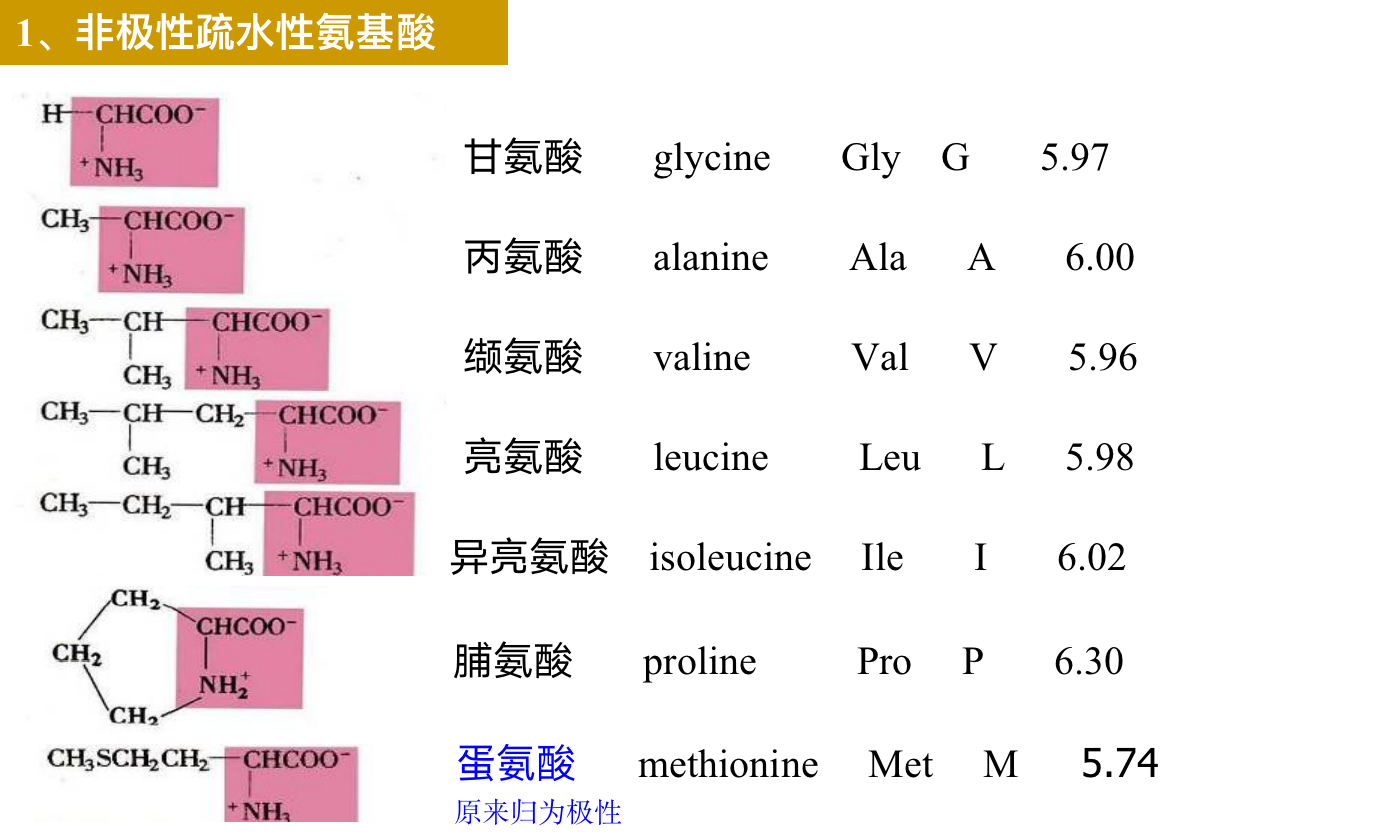
b) 非极性氨基酸: Gly, Ala, Val, Leu, Ile, Pro, Phe, Met(疏水作用,维系蛋白质三级结构)
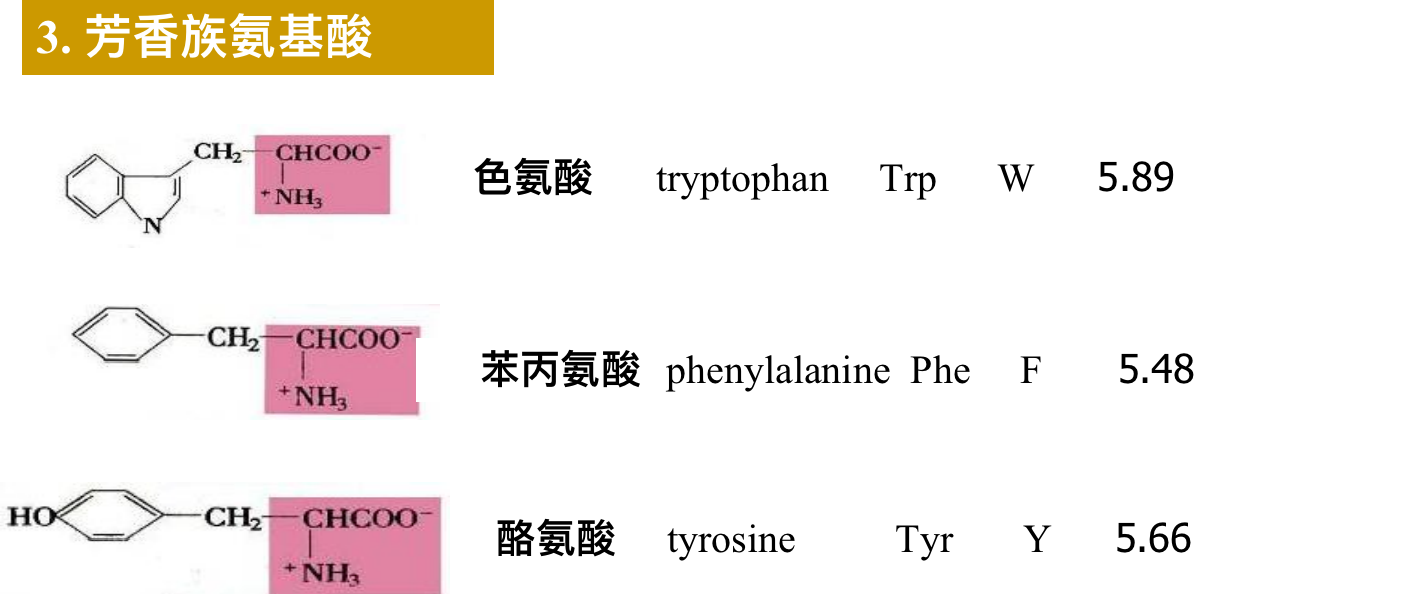
2. 芳香族氨基酸:Phe, Tyr, Trp; 侧链含有苯环。
- 此外还有杂环、蒽环族氨基酸
- 酸性氨基酸— Glu, Asp;侧链基团在中性溶液中解离后带负电荷的氨基酸(释放了H+到溶液中)。
4. 碱性氨基酸—His, Arg, Lys;侧链基团在中性溶液中解离后带正电荷的氨基酸(结合了H+ ,溶液中剩下OH-) 。


必需氨基酸
生命活动所必需的但是人体自身不能合成的氨基酸
成人:Ile, Leu, Phe, Met,Trp, Thr, Lys, Val, His
租一两本淡色书来学(组异亮苯蛋色苏赖缬) 是由于人体不能合成这些氨基酸的骨架(α-酮酸)
婴儿时期所需:Arg,His
稀有氨基酸
- 不是通过直接的遗传密码翻译生成,而是由相应的氨基酸残基经过加工修饰形成的,如羟脯氨酸,胱氨酸等。
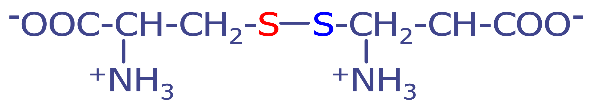
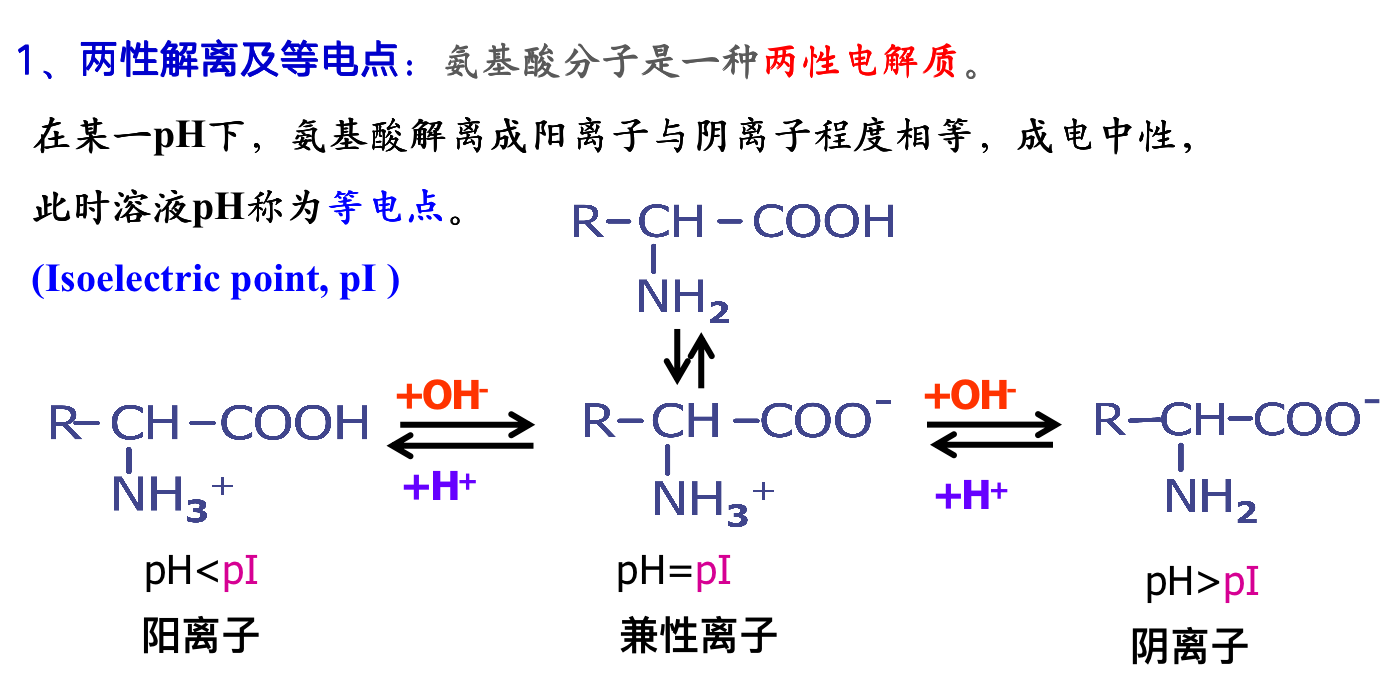
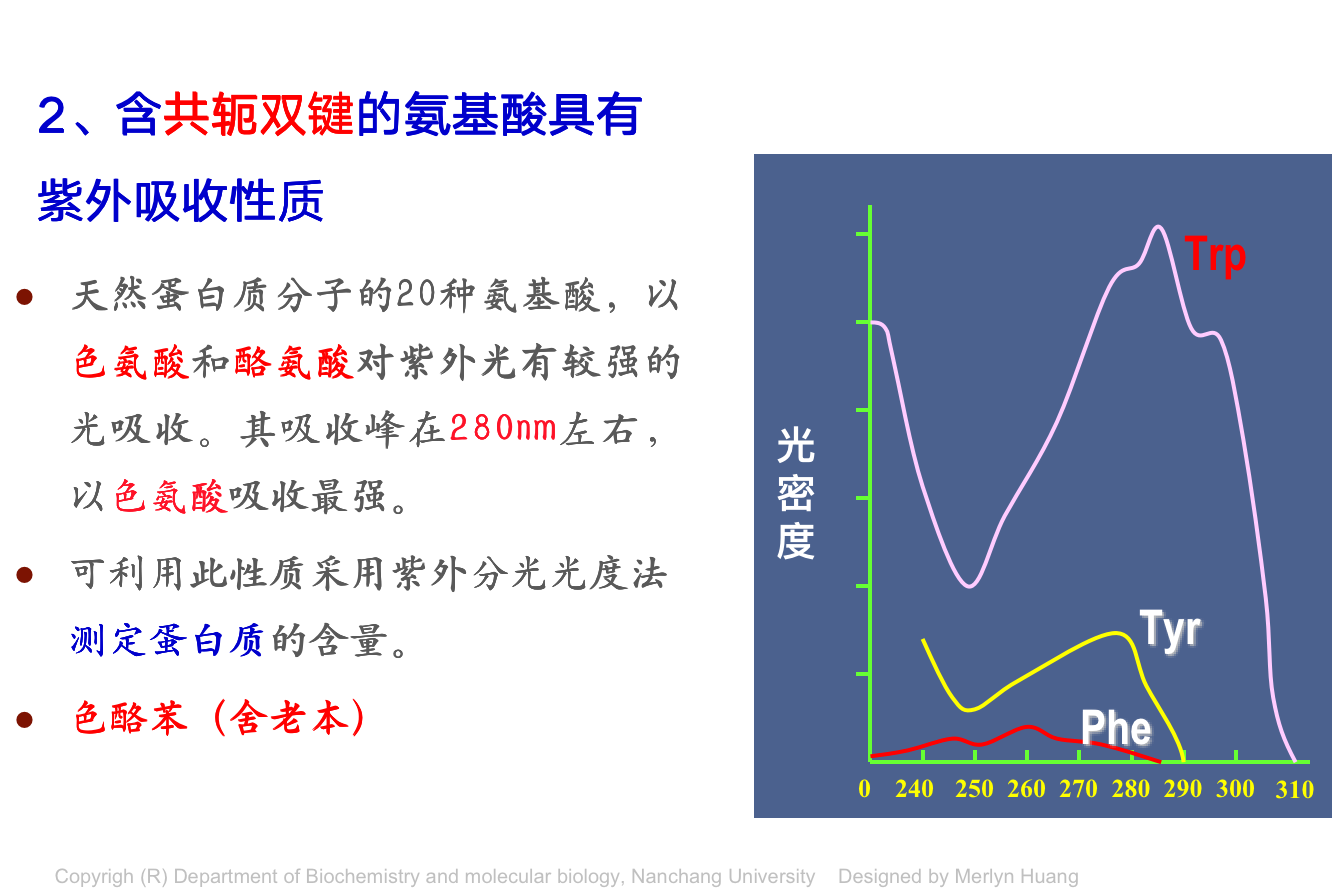
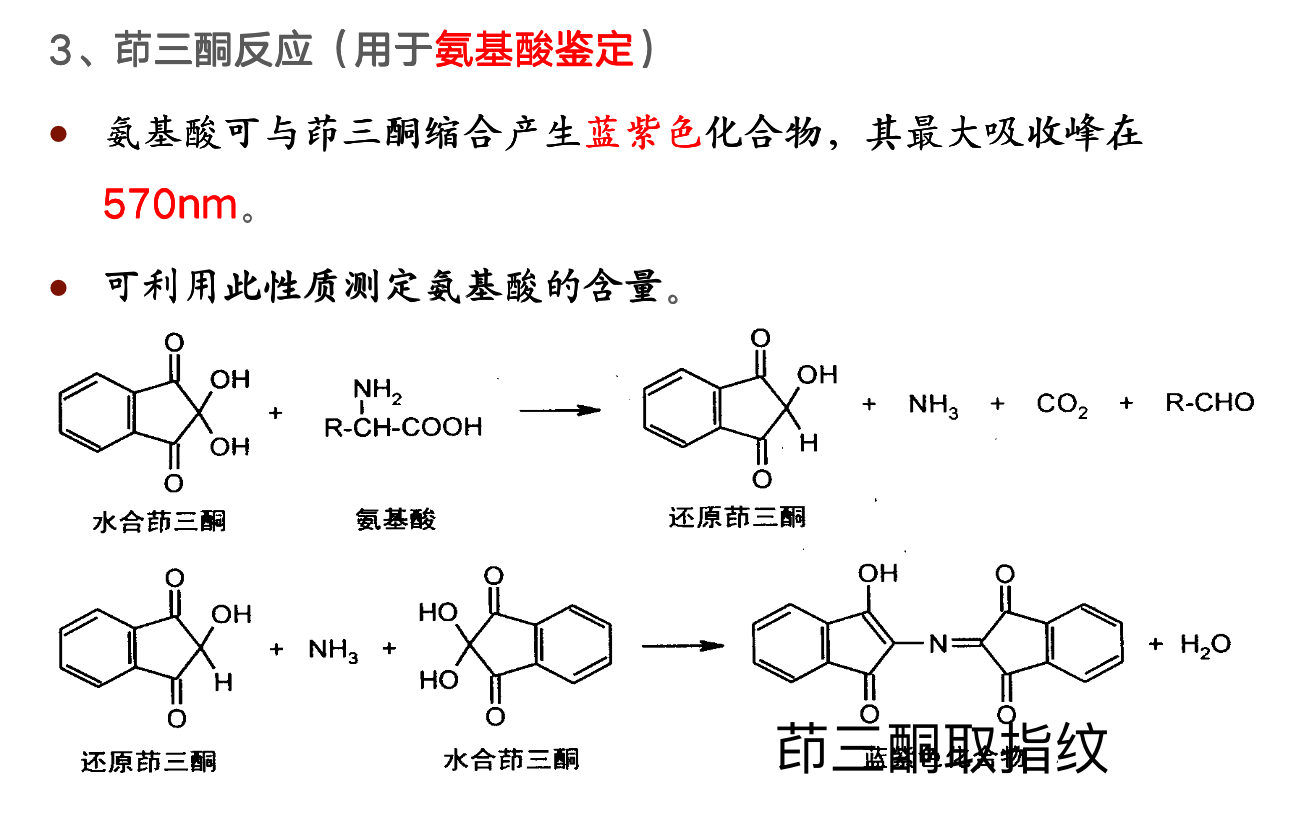
氨基酸的理化性质
氨基酸的用途简介
在医学上的应用
精氨酸:能降低肝脏机能严重障碍所致的高氨血症,对预防和推迟肝昏迷的到来有一定效果;
- 天冬氨酸:钾镁盐可用于恢复疲劳;治疗低钾症心脏病、肝病、糖尿病等。
- 半胱氨酸:能促进毛发的生长,可用于治疗脱发;甲酯盐酸盐可用于治疗支气管炎等;
组氨酸:可扩张血管,降低血压,用于心绞痛,心功能不全等疾病的治疗。
食品工业上的应用
营养强化剂(复合氨基酸口服液、注射液);
- 谷氨酸钠-味精;
- 天冬氨酸钠:可用于清凉饮料,能增加清凉感、并使香味浓厚爽口;在醋、鱼类罐头、面包、饮料等广泛使用。
天冬氨酰苯丙氨酸甲酯:——阿斯巴甜
一个氨基酸分子的α-羧基与另一个氨基酸分子的α-氨基在适当的条件下经脱水缩合即生成肽(peptide)。
- 由两个氨基酸形成的肽叫二肽;少于10个aa的肽叫寡肽;多于10个少于50个aa的肽叫多肽,50以上称为蛋白质。
肽链中的氨基酸分子因为脱水缩合而基团不全,被称为氨基酸残基(residue)。
几种生物活性肽
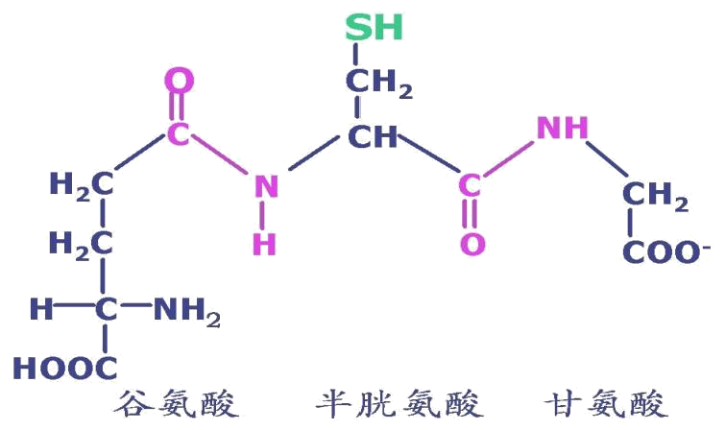
谷胱甘肽(glutathione, GSH)
谷胱甘肽的生理功用
解毒作用:与毒物或药物结合,消除其毒性作用;
- 参与氧化还原反应:作为重要的还原剂,参与体内多种氧化还原反应;
- 保护巯基酶的活性:使巯基酶的活性基团-SH维持还原状态;
- 维持红细胞膜结构的稳定:消除氧化剂对红细胞膜结构的破坏作用。
-
多肽类激素和神经肽
主要见于下丘脑及垂体分泌的激素,如催产素(9肽)、加压素(9肽)、促肾上腺皮质激素(39肽)、促甲状腺素释放激素(3肽)
-
蛋白质的分子结构
蛋白质的一级结构
定义:是指多肽中由N-端至C-端的氨基酸的排列顺序,主要靠肽键维系
- 是多肽链中氨基酸(残基)的排列顺序,是蛋白质作用的特异性、空间结构、生物学功能的基础。
- 包括三种形式:直链多肽;分支直链多肽;环肽
- 维系键主要是肽键,还有二硫键
- 肽:两个或两个以上氨基酸通过肽键共价连接形成的化合物(肽键数量等于氨基酸数-1(非环肽情况))
- 氨基酸残基:肽键中的氨基酸分子因为脱水缩合而基团不全
-
蛋白质构象
蛋白质构象室蛋白质的原子和基团在三维空间上的排布、分布及肽链的走向。蛋白质构象分部为蛋白质的二级结构、三级结构、四级结构
- 肽键的C及N周围三个键角之和均为360°,说明都处于一个平面上,也就是说肽单位的六个原子基本上同处于一个平面,是一个刚性平面,这就是肽键平面。
- 蛋白质变性主要是因为破坏了维持和稳定其空间构象的各种次级键,使得天然蛋白质的物理、化学、生物学性质发生改变
- 维持蛋白质构象的化学键:主要有:氢键、疏水键、盐键、范德华力、配位键
- 氢键:常见于连接在一电负性很强的原子上的氢原子,与另一电负性很强的原子之间,如 >C=O ┅┅ H-N<。
- 疏水键:非极性基团因避开水相而聚集在一起的作用力,这种力称为疏水键或疏水作用力。这种力导致蛋白质疏水氨基酸藏于分子内部。
- 离子键:离子键,又称为盐键是由带正电荷基团与带负电荷基团之间相互吸引而形成的化学键。在近中性环境中,蛋白质分子中的酸性氨基酸残基侧链电离后带负电荷,而碱性氨基酸残基侧链电离后带正电荷,二者之间可形成离子键。
副键(次级键),受加热等易断裂导致变性
蛋白质的二级结构是指蛋白质多肽链主链原子局部的空间结构,不涉及侧链构象,包括α-螺旋,ß-折叠,ß-转角及Ω环等。
- 维系蛋白质二级结构的主要化学键是氢键。
-
α-螺旋
α-螺旋是多肽链的主链原子沿一中心轴盘绕所形成的有规律的螺旋构象,其结构特征为:
- 右手螺旋,螺旋每圈包含3.6个氨基酸残基,螺距为0.54nm,直径0.23nm
- 相邻2圈α螺旋间第1个肽单位的C=O与第4个肽单位的N-H形成氢键,氢键方向与螺旋纵轴平行,链内氢键是α螺旋稳定的主要因素
- 侧链基团位于螺旋外,对螺旋的形成与稳定有影响。
- 蛋白表面的α-螺旋,3-4个疏水AA交替排列,有疏水一侧,亲水性一侧。常见Ala, Glu, Leu, Met
影响alpha-螺旋稳定的因素
定义:指由两条或两条以上几乎完全伸展的肽链平行排列,通过链间氢键交联而成。肽键的主链成锯齿状折叠构象
- ß-折叠是由若干肽段或肽链排列起来所形成的折纸状片层构象
- 肽链平行或反平行通过链间氢键交联而成
- 结构特征:
- 由若干条肽段或肽链平行或反平行排列组成片状结构;
- 主链骨架伸展呈锯齿状;
- 借相邻主链之间的氢键维系。氢键的方向与肽链长轴垂直
- 肽链中氨基酸的残基的R侧链分布在片层上下。
-
ß-转角
定义:ß-转角是多肽链180°回折部分所形成的一种二级结构
-
蛋白质的三级结构
概念:是指蛋白质分子或亚基内所有原子的空间排布,也就是一条多肽链在三维空间的整体排布。
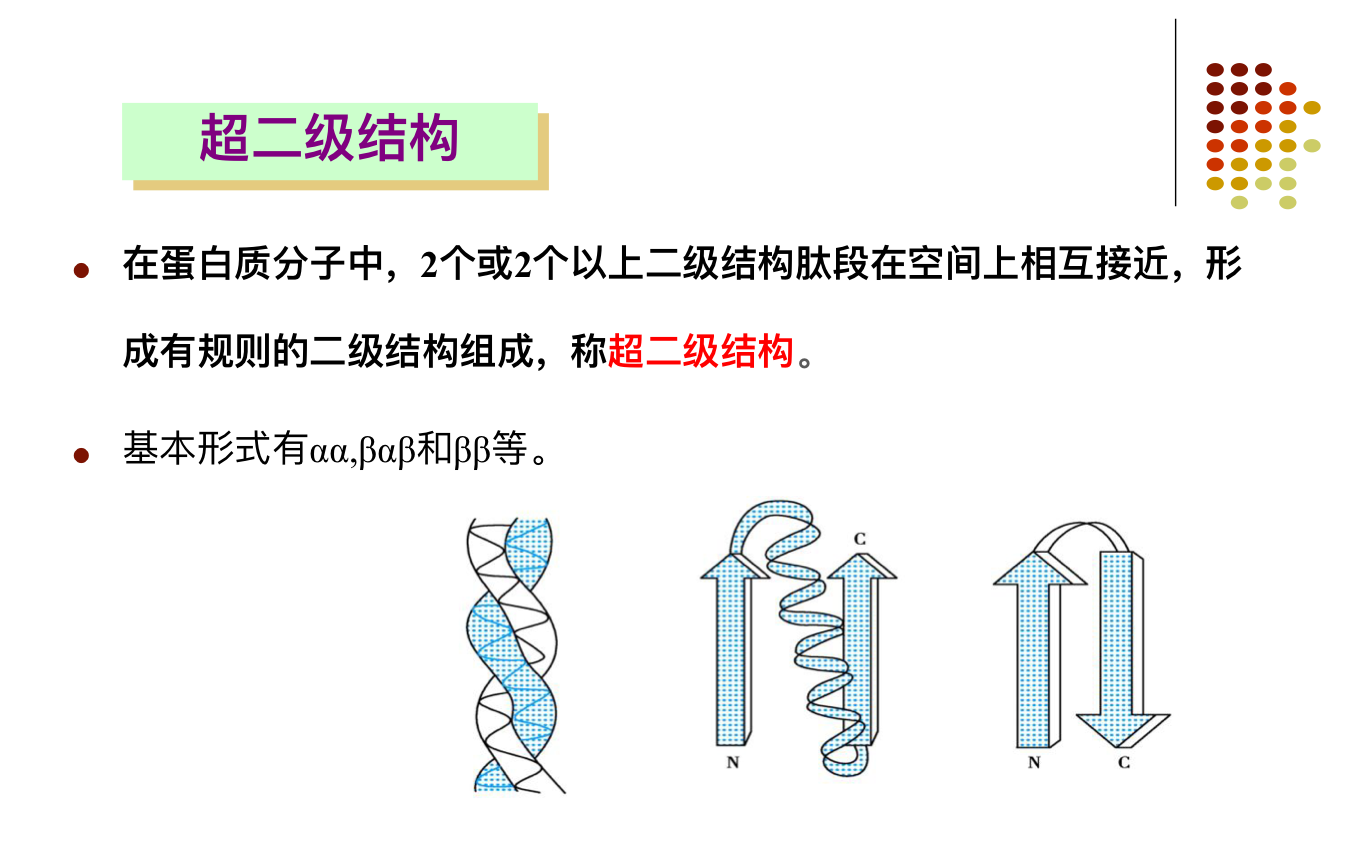
含有多种二级结构并具有明显的折叠层次。常形成超二级结构或结构模体,并进一步折叠形成特定构象(结构域)。
结构模体 motif
在蛋白质分子中,具有特定空间构象和特定功能的结构体,称模体。
超二级结构
结构域

蛋白质的三级结构是指在一条多肽链中所有原子的整体空间排布,包括主链和侧链。三级结构的形成使得在序列中相隔较远的氨基酸侧链互相靠近
通过提供一个保护的环境从而加速蛋白质折叠成天然构想或形成四级结构
- 伴侣蛋白则形成大的桶状结构容纳部分折叠的蛋白质完成折叠。
一旦蛋白质折叠好,分子伴侣即被释放,然后再参与另一个新生蛋白质的折叠。
蛋白质的四级结构
蛋白质的四级结构由两个或两个以上具独立三级结构的多肽链之间的相互作用,以非共价方式连接成的大分子间构象。
- 其中上述指的具独立三级结构的多肽链称为亚基。
- 亚基单独存在不具有生物活性。
- 蛋白质颗粒表面的电荷层和水化膜是蛋白质亲水胶体稳定的两个因素,当到等电点时,是蛋白质溶解度最低