写在前面
转座机制
LTR 逆转座子和逆转录病毒具有相似的结构特征和复制机制。
首先,LTR 逆转座子在细胞核内转录形成一条 mRNA,随后被转移到细胞核外。部分 mRNA 形成二聚体;部分 mRNA 编码转座必须的蛋白酶,随后二聚体 mRNA 和转座必须的蛋白酶被包裹到类病毒颗粒(Virus-like particle, VLP)内,形成一个独立的空间结构。在类病毒颗粒内,tRNA 和 PBS 序列结合,作为 cDNA 链合成的引物,随后 cDNA 链在 RT 的催化作用下开始合成。当 cDNA 链延伸到 mRNA 链 5’末端停止合成。
然后,RT 利用 tRNA 3’ 端自由羟基为引物,合成互补的 RNA-DNA 链。
接着,RH 水解 RNA-DNA 链上的 RNA,以 3’ 端靠近 LTR 区域的 PPT 位点作为引物,促进第二条 cDNA 的合成。
最后,两条 DNA 链相互作为模板,各自合成剩下的部分 DNA。这样合成的 LTR 逆转座子,其两端的 LTR 序列完全一致,这也是计算 LTR 逆转座子插入宿主基因组年龄的理论基础。待新的 LTR 逆转座子合成后,类病毒颗粒转移并定位到细胞核上,具有完整结构的转座子双链 DNA 转移至细胞核内,随后这个新的元件插入到宿主基因组中,形成一个新的拷贝,在这个新拷贝插入位点的两侧会形成几个碱基的靶位点重复序列,称为 TSD 序列(Target site duplication,TSD),一般 TSD 的长度为 4 - 6 bp 不等。
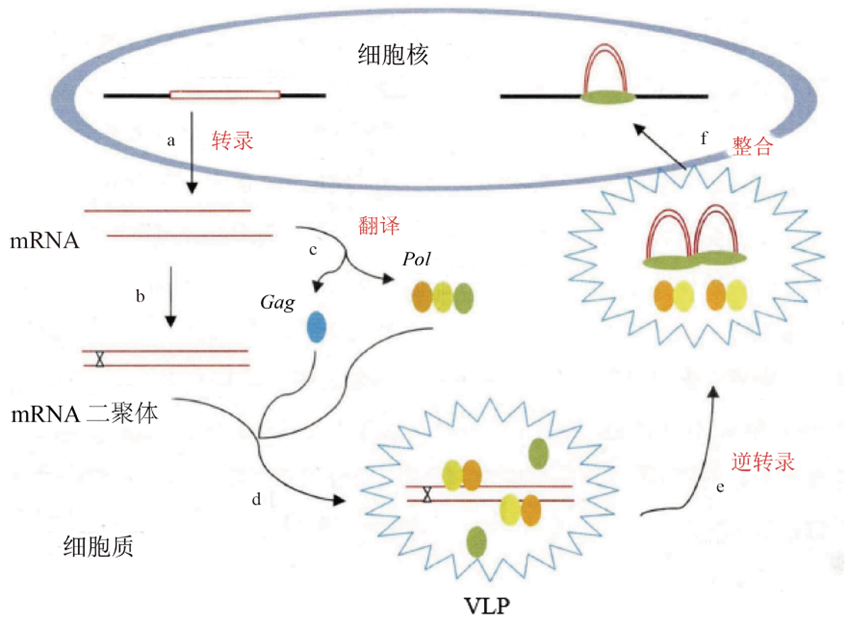
LTR 逆转座子的生活史
注:a. mRNA 的转录;b. 部分 mRNA 形成二聚体;c. 部分 mRNA 编码转座必须的蛋白酶;d. 二聚体 mRNA 和转座必须的蛋白酶被包裹到VLP内,形成一个独立的空间结构;e. 在VLP 内,进行逆转录,完成双链 cDNA 合成和 INT 与 LTR 的连接;f. 双链断裂和新合成拷贝在新基因组位置的整合
抑制机制
宿主基因组中抑制 LTR 逆转座子转座机制的进化对于最大限度地减少它们对宿主的可能有害影响是至关重要的。沉默机制和清除机制是目前常见的有效抑制 LTR 逆转座子转座的手段,也在维持基因组稳定和调节基因表达中发挥重要作用。
沉默机制的启动,需要经过宿主对转座子的特异识别和沉默。这个特异的识别过程主要是由转座子产生而非宿主基因产生的双链 RNA(Double stranded RNA,dsRNA)。这种 dsRNA 经加工形成短双链体,加载到 RNA 诱导的沉默复合物(RNA induced silencing complex,RISC)上,该复合物将相关的 siRNA 引至靶向 mRNA,该靶向 mRNA 被 RISC 复合物切割。靶向 mRNA 的这种降解通常被称为转录后基因沉默 (Posttranscriptional gene silencing, PTGS)。在植物中,除了靶向 mRNA 的降解外,dsRNA 还可以通过 RNA 指导的 DNA 甲基化 (RNA directed DNA methylation, RdDM) 导致转录基因沉默 (Transcriptional gene silencing, TGS),这一过程会导致 DNA 甲基化和组蛋白修饰。研究表明,DNA 甲基化和组蛋白修饰在LTR 逆转座子的转座表达调控上都起着非常重要的主导作用。
因为能快速复制并获得非常高的拷贝数,LTR 逆转座子通常是基因组大小变化并使其不稳定的主要因素。因此,清除LTR 逆转座子也是宿主进化的方向。目前,两种重组机制可以从宿主基因组中去除LTR 逆转座子:不等重组 (Unequal recombination) 和不规则重组 (Illegitimate recombination)。来自相同元件的同源 LTR 之间的不相等重组留下一个被 TSD 包围的孤立LTR (Solo LTR),相反,当不等重组发生在不同LTR 逆转座子的 LTR 之间时,可能会形成没有侧翼 TSD 的孤立LTR。不同于不等重组,不规则重组可能是由双链 DNA 断裂后非同源末端连接引起的部分缺失产生截断的LTR 逆转座子 (Truncated LTR-RTs)。大量研究发现,正是这两种使LTR 逆转座子序列从植物基因组中去除的作用限制了植物基因组朝着增大的单方向发展进化。

