“谈癌色变” 的时代远未过去,早筛早诊早治已成为对抗癌症的利器。DNA 甲基化标志物悄然登上舞台,但不同标志物用于不同种癌。能否找到不同癌症共有的甲基化标志物,从而将它们一网打尽。复旦大学生物医学研究院、上海市公共卫生临床中心于文强教授课题组深耕 DNA 甲基化研究二十余年,鉴定了一类或可适用于全部癌症的甲基化标志物——全癌标志物 (Universal Cancer Only Marker,UCOM)。
继 2019 年在 Cancer Research 杂志 (IF=12.701) 发表了第一个全癌标志物 HIST1H4F,近期他们联合上海交通大学医学院附属国际和平妇幼保健院、复旦大学附属妇产科医院、复旦大学附属金山医院、上海奕谱生物科技有限公司等在 Clinical and Translational Medicine 杂志 (IF=11.492) 发表了第二个全癌标志物 PCDHGB7。《科技日报》对相关研究进行了报道。

第一个全癌标志物 HIST1H4F

新的全癌标志物 PCDHGB7

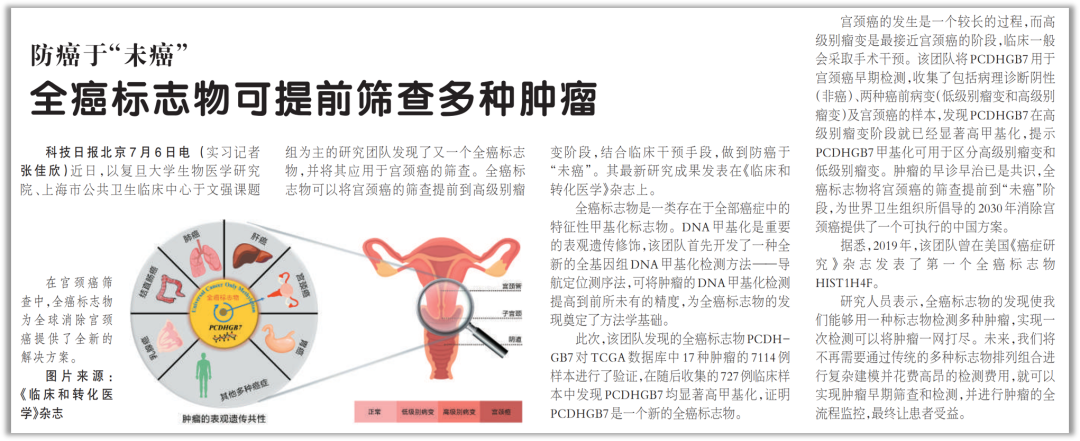
《科技日报》报道全癌标志物研究
报道链接:http://digitalpaper.stdaily.com/http_www.kjrb.com/kjrb/html/2021-07/08/content_471323.htm?div=-1
以下深入解读全癌标志物的发现历程及其对于癌症研究和早期筛查的重要意义:
DNA 甲基化标志物的时代已经到来
2020 年全球新增癌症患者约 1930 万,因癌症死亡约 1000 万人 [1],全球约 1/6 的死亡由癌症造成 [2]。中国是癌症大国,2020 年癌症发病人数约 457 万人,死亡约 300 万人 [1] ,平均每天超过 1 万人被确诊为癌症。值得警惕的是,癌症并没有因为现代医学的发展而式微;相反,十多年来,恶性肿瘤的发病率每年保持约 3.9% 的增幅,死亡率每年保持 2.5% 的增幅 [3]。我国每年恶性肿瘤的医疗花费超过 2200 亿元,已经成为家庭和医保基金的重要支出,而癌症的预防、筛查和早诊早治是防控癌症最经济有效的途径。
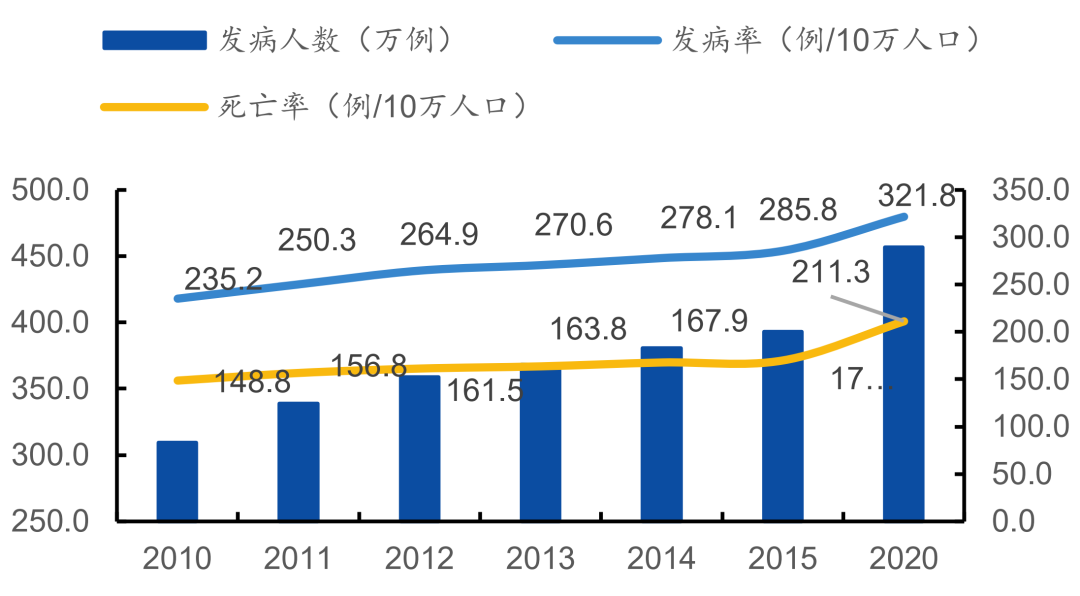
图 1. 2010-2020 年国内癌症发病 / 死亡率持续上升
肿瘤标志物是指特征性存在于恶性肿瘤细胞,或由恶性肿瘤细胞异常产生的物质,或是宿主对肿瘤的刺激反应而产生的物质,并能反映肿瘤发生、发展,监测肿瘤对治疗反应的一类物质。研究发现,DNA 上可以发生化学修饰,比如甲基化,DNA 甲基化具有调控基因表达的功能。在正常细胞癌变为肿瘤细胞的进程中,DNA 甲基化会发生变化,因此 DNA 甲基化具有成为肿瘤标志物的潜力。
尽管 DNA 甲基化可用于肿瘤的早筛、早期诊断、疗效预测、预后判断等,但是其应用还存在一些挑战。首先,针对不同的癌症类型,往往有不同的肿瘤标志物;换言之,如果我们想要做全身的检查,需要检测多个标志物;其次,哪怕对于特定的肿瘤,通常需要多个甲基化标志物的联合检测,有时候甚至需要依赖于一些复杂的算法;另外,目前的甲基化检测主要依赖于焦磷酸测序或高通量测序(NGS),两者均需要价格昂贵的仪器。这些问题限制了甲基化标志物的现实应用。
没有 GPS,就没有全癌标志物
人类的遗传信息主要储存在由 A、G、C、T 组成的 DNA 中。人类基因组中约有 30 亿个碱基对。DNA 甲基化主要发生在 CpG 位点中的 C 上,人类基因组中约有 2800 万个 CpG 位点。其中正常的细胞中 60%~80% 的 CpG 位点被甲基化,而细胞癌变后,只有 20%~50% 的 CpG 位点被甲基化,换言之细胞在癌变过程中有 10%~60% 的 CpG 位点,即 280~1680 万个 CpG 位点的甲基化可能发生变化。
要想全面了解人类基因中的 DNA 甲基化的全景,通常需要借助全基因组 DNA 甲基化测序技术,然而这是一场 “富人的烧钱游戏”。为何会这么烧钱,一方面是因为要测的位点很多,另一方面则归咎于测序的策略:DNA 需要经过重亚硫酸盐处理,没有甲基化的 C 转变成了 T,构成 DNA 的序列就剩下了 A、T、G 三个碱基;而测序后的数据需要与人类参考基因组比对。由于处理后的基因组复杂度已经降低,致使很多序列无法比对回去,这部分无法比对的数据就白测了。最早的全基因组 DNA 甲基化检测的比对率只有不到 30% [4],也就是说你花费了 100 元钱,只有 30 元钱是有用的,那 70 元钱测到的序列因为 “无家可归” 而被白白扔掉了,造成了数据的浪费,人力物力财力的浪费。
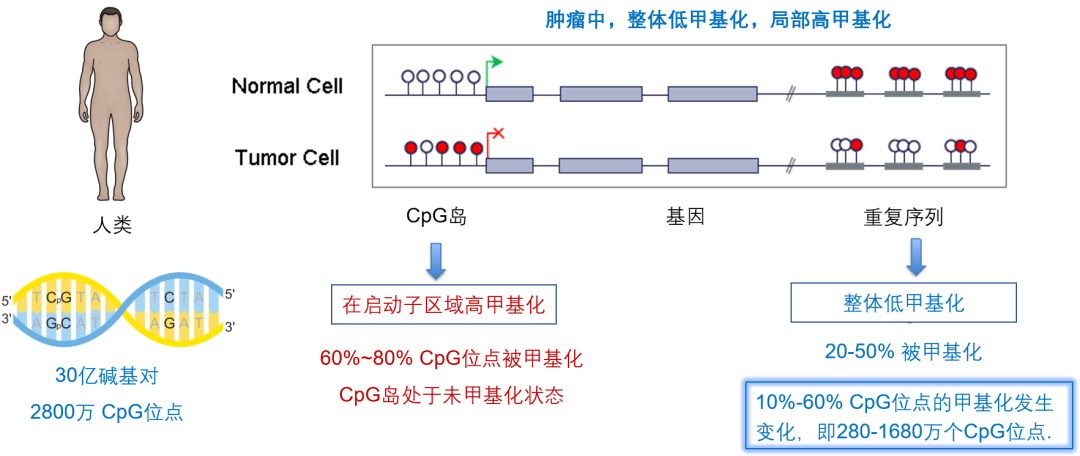
图 2. 人类基因组 DNA 甲基化概况
为了突破传统 DNA 甲基化测序方法中比对率低的瓶颈,我们课题组经过 8 年的攻关,借助双端测序,即测序的一端是基因组原序列,另一端是转化后表观序列,比对率低问题迎刃而解。我们将这种全基因组 DNA 甲基化检测方法命名为 GPS (Guide Positioning Sequencing),即 “导航定位测序” [5],目前已经获得国内和国际专利。借助拥有自主知识产权的 GPS 技术,全基因组 DNA 甲基化检测将更精准,无论是检测的准确性还是覆盖度均远超全基因组甲基化检测 “金标准”WGBS (whole-genome bisulfite sequencing),基于此,我们可以看到别人看不到的规律,我们也可以发现别人发现不了的东西,全癌标志物的发现就是一个典型的例子。关于 GPS 测序技术的深入解读,详见《给 DNA 甲基化检测装上 GPS,看肿瘤细胞如何变花样》[6]。
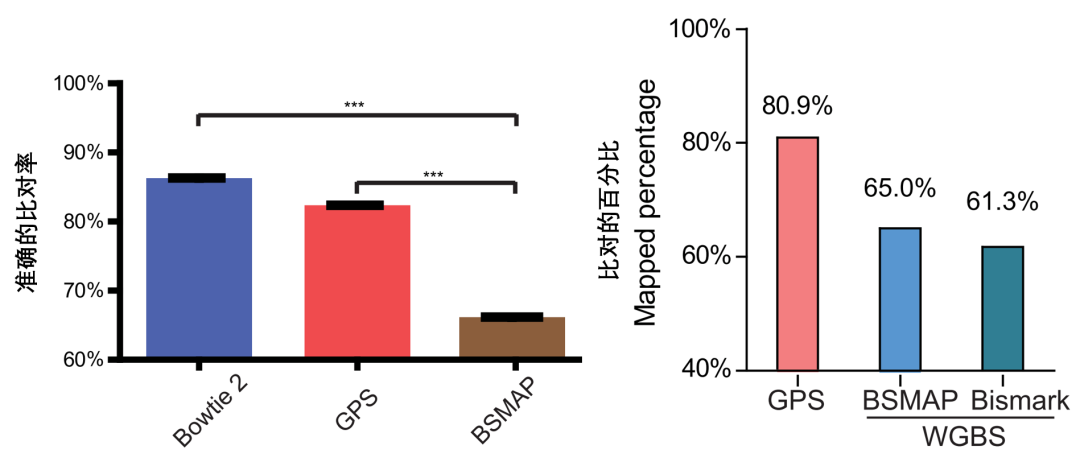
图 3. GPS 比 WGBS 具有更高的比对率
在全基因组甲基化的分析过程中,我们注意到很多组蛋白基因在多种肿瘤中都呈现高甲基化。这引起了我们的极大兴趣,这些位点能否揭示肿瘤的共有特征?是否具有开发为肿瘤标志物的潜力呢?
第一个全癌标志物 HIST1H4F 及其应用
HIST1H4F 作为全癌标志物的验证
真核生物细胞中组蛋白包括四种核心组蛋白 H2A、H2B、H3、H4 和一种连接组蛋白 H1。DNA 双链缠绕在两分子的 H2A、H2B、H3、H4 组成的八聚体上,组装成染色质的基本单位核小体,H1 结合于两个核小体之间。生命科学的研究者也会对种类繁多的组蛋白修饰十分熟悉,但组蛋白基因却鲜有人问津。
目前已发现的人类组蛋白基因共有 85 个,包括 68 个复制依赖性组蛋白基因与 17 个非复制依赖性组蛋白变体基因。大部分组蛋白基因在染色体上成簇分布。人类染色体上主要有 2 个组蛋白基因簇,分别是组蛋白基因簇 1(位于 Chr6p21)与组蛋白基因簇 2(位于 Chr1q21),其他的组蛋白基因散在分布于染色体其他位置。
为了证实 GPS 揭示的组蛋白基因的肿瘤中的高甲基化,我们在 TCGA 数据库的 17 种肿瘤的 7000 多例样本中分析发现,许多组蛋白基因确实在多种肿瘤中发生异常高甲基化,尤其是 HIST1H4F 基因。
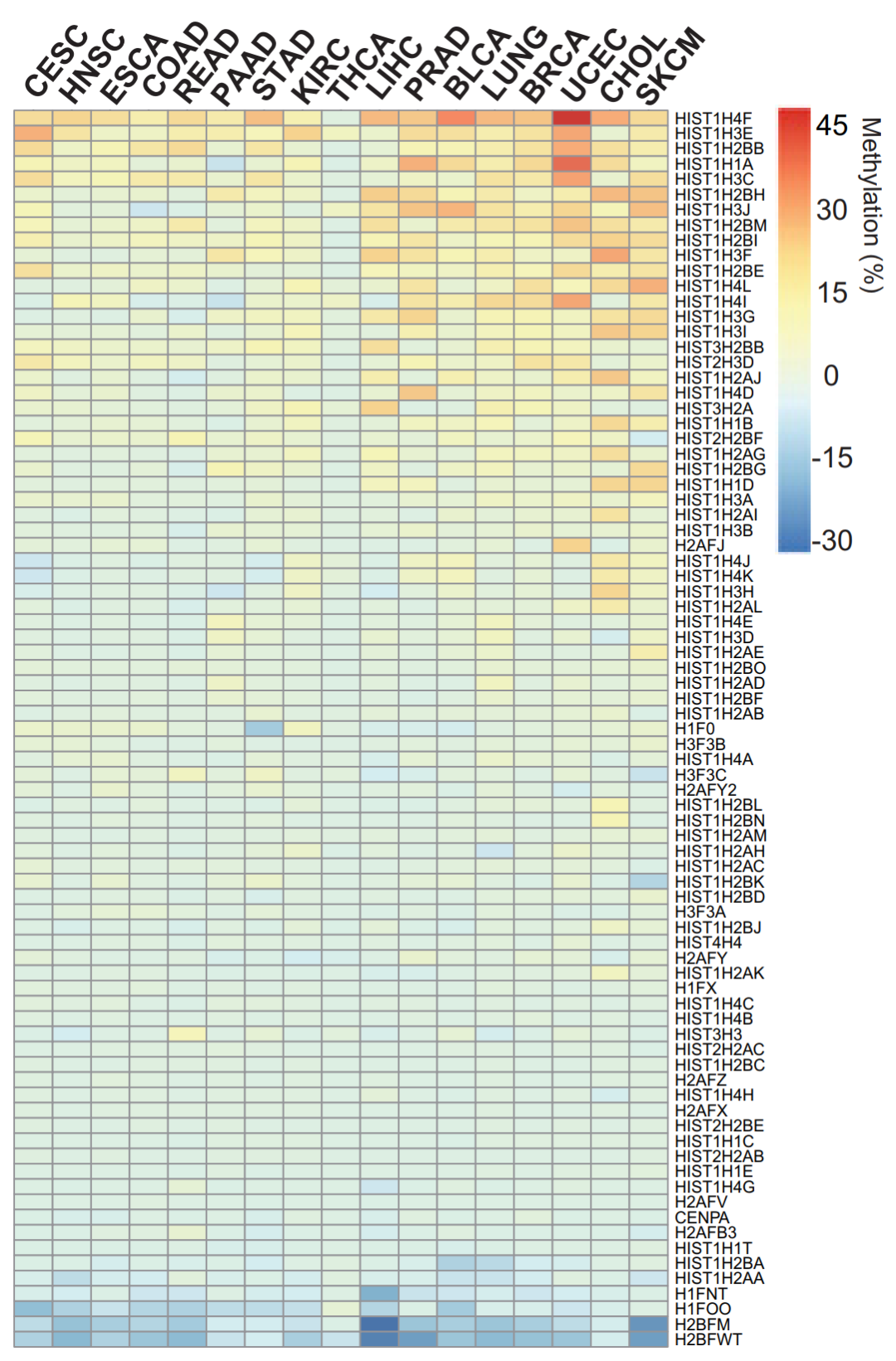
图 4. 在 17 种肿瘤中 85 种组蛋白基因的甲基化状态
CESE, 宫颈癌; HNSC, 头颈部肿瘤; ESCA, 食管癌; COAD, 结肠腺癌; READ, 直肠腺癌; PAAD, 胰腺癌; STAD, 胃腺癌; KIRC, 肾透明细胞癌; THCA, 甲状腺癌; LIHC, 肝癌; PRAD, 前列腺癌; BLCA, 膀胱尿路上皮癌; LUNG, 肺癌; BRCA, 乳腺癌; UCEC, 子宫内膜癌; CHOL, 胆管癌; SKCM, 黑色素瘤
随后我们将目光聚焦到 HIST1H4F 基因。我们发现在分析的 17 种肿瘤中 HIST1H4F 均显著高甲基化。为了进一步证实 TCGA 数据库中的结果,我们收集到了 8 种肿瘤临床样本,HIST1H4F 在所有肿瘤中均存在高甲基化。据此,我们认为 HIST1H4F 是潜在的肿瘤共有标志物,我们将之命名为 “全癌标志物” (Universal Cancer Only Marker, UCOM)。
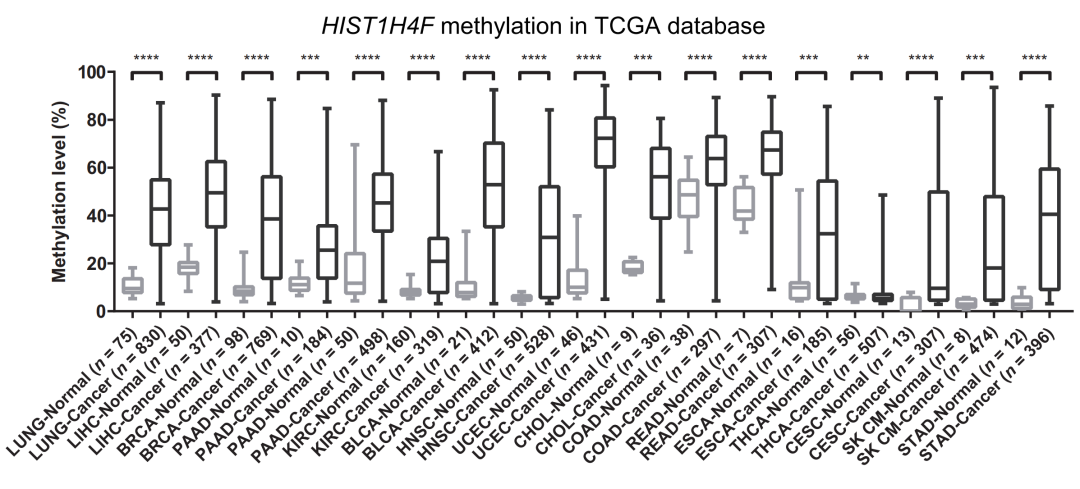
图 5. 在 17 种肿瘤中 HIST1H4F 的甲基化状态
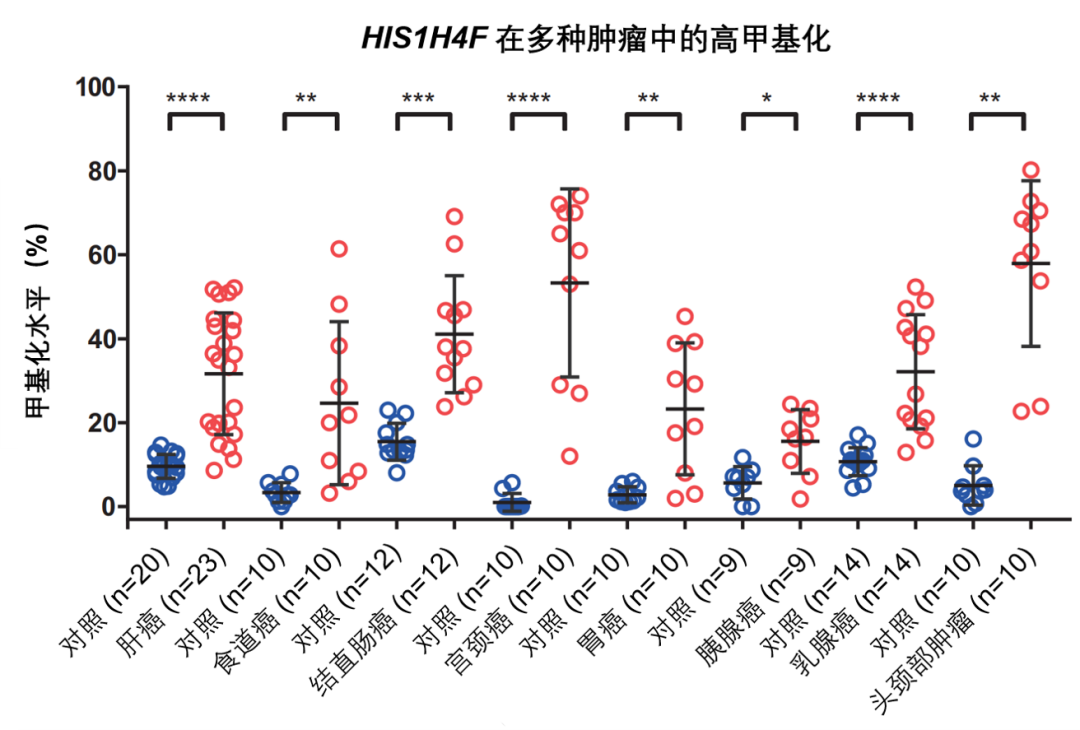
图 6. 在 8 种肿瘤临床样本中 HIST1H4F 均高甲基化
HIST1H4F 高甲基化与肺癌检测
肺癌是全球死亡人数最多、发病人数第二多的癌症,肺癌的早期检测对于提高肺癌患者的生存率至关重要。肺泡灌洗液 (Bronchoalveolar Lavage Fluid, BALF) 是利用支气管镜向支气管肺泡中注人生理盐水灌洗后收集吸出的液体,通过检查肺泡灌洗液中的组分,可进行多种疾病的诊断,如肺部感染、肺癌等。为了验证 HIST1H4F 能否用于肺癌的检测,我们收集了 206 例肺癌患者与 59 例肺部良性疾病患者的肺泡灌洗液。
结果显示,HIST1H4F 基因在肺癌患者的肺泡灌洗液样本中显著高甲基化。在训练集中,HIST1H4F 高甲基化的检测特异性高达 96.7%,检测敏感性 87.0%;在验证集中,检测特异性高达 96.5%,敏感性 87%。这说明 HIST1H4F 高甲基化在肺癌检测中具有非常高的潜在临床应用价值。
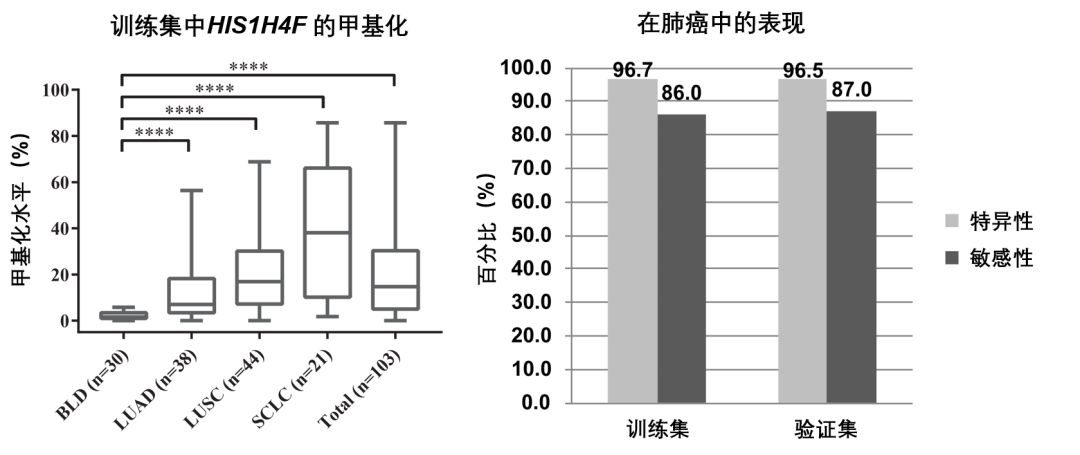
图 7. HIST1H4F 高甲基化在肺癌筛查中的表现
BLD, 良性肺病; LUAD, 肺腺癌; LUSC, 肺鳞癌; SCLC, 小细胞肺癌
以上研究证实 HIST1H4F 高甲基化可以作为 “全癌标志物”(Universal Cancer Only Marker, UCOM),并验证了其在肺癌检测中的优异表现。相关研究于 2019 年 12 月发表于 Cancer Research [7]。
在发现 HIST1H4F 的过程中,我们还注意到了一类在肿瘤中高甲基化的基因——PCDH 家族基因。通过进一步的筛选和验证,我们发现其中的 PCDHGB7 基因在多种肿瘤中高甲基化,于是我们将目光转向了 PCDHGB7。
第二个全癌标志物 PCDHGB7 将宫颈癌筛查提前到 “未癌” 阶段
PCDHGB7 作为全癌标志物表现优异
为了系统探索 PCDHGB7 是否可以作为新的全癌标志物及其临床应用,我们联合上海交通大学医学院附属国际和平妇幼保健院、复旦大学附属妇产科医院、复旦大学附属金山医院、上海奕谱生物科技有限公司等单位进行了全面的探索。证实 PCDHGB7 确实是一个新的全癌标志物,并可用于宫颈癌早期检测。相关研究于 2021 年 6 月底发表于 Clinical and Translational Medicine [8]。
首先我们利用 TCGA 数据库(7114 例样本)数据进行分析,发现与非癌组织相比,在 17 种肿瘤中 PCDHGB7 均显著高甲基化。
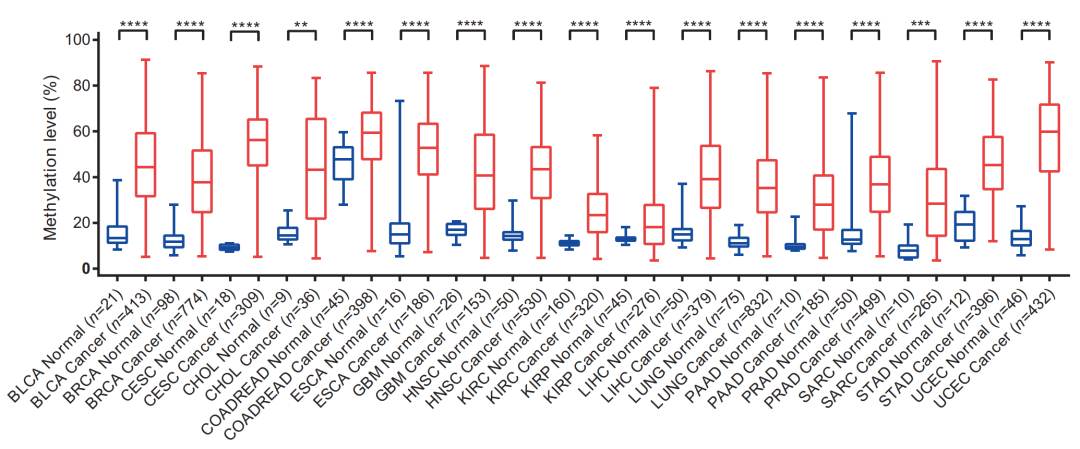
图 8. 在 17 种肿瘤中 PCDHGB7 均显著高甲基化
为了进一步验证这个结果,我们收集到了 13 种组织类型的临床样本(727 例),发现在所有检测的癌症类型中,PCDHGB7 均显著高甲基化。这些结果证实 PCDHGB7 是一个新的全癌标志物。
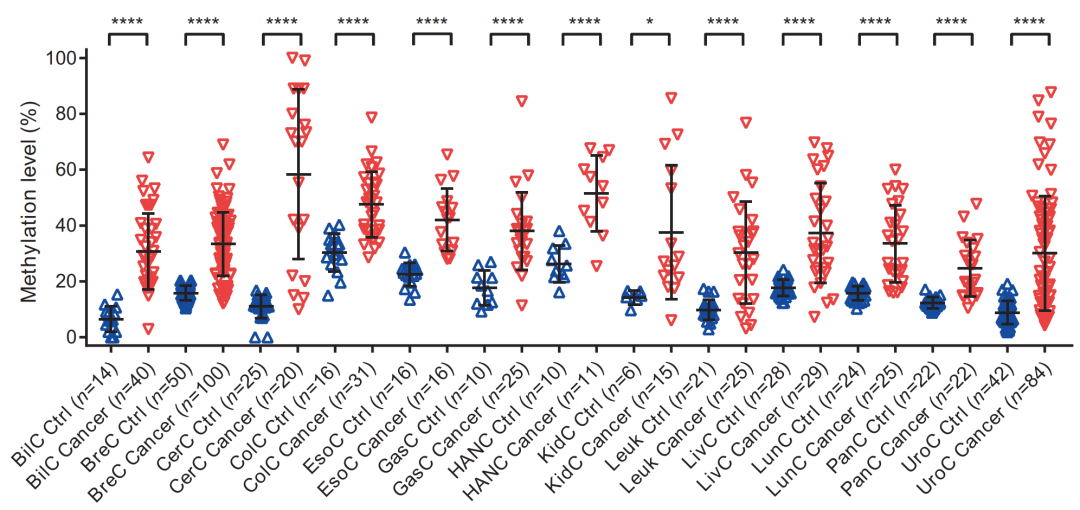
图 9. 在 13 种肿瘤的临床样本中
PCDHGB7 均显著高甲基化
PCDHGB7 用于宫颈癌的早期检测
有了新的标志物,我们要解决什么问题呢?宫颈癌是长期以来困扰女性的癌症,全球每年新增宫颈癌超过 50 万,每年死亡超 30 万。现行的宫颈癌筛查主要依赖于高风险的 HPV 检测和 ThinPrep 细胞学检测 (ThinPrep cytologic test, TCT),但它们的敏感性存在一定局限性,尤其对于早期的癌前病变检测能力不足。
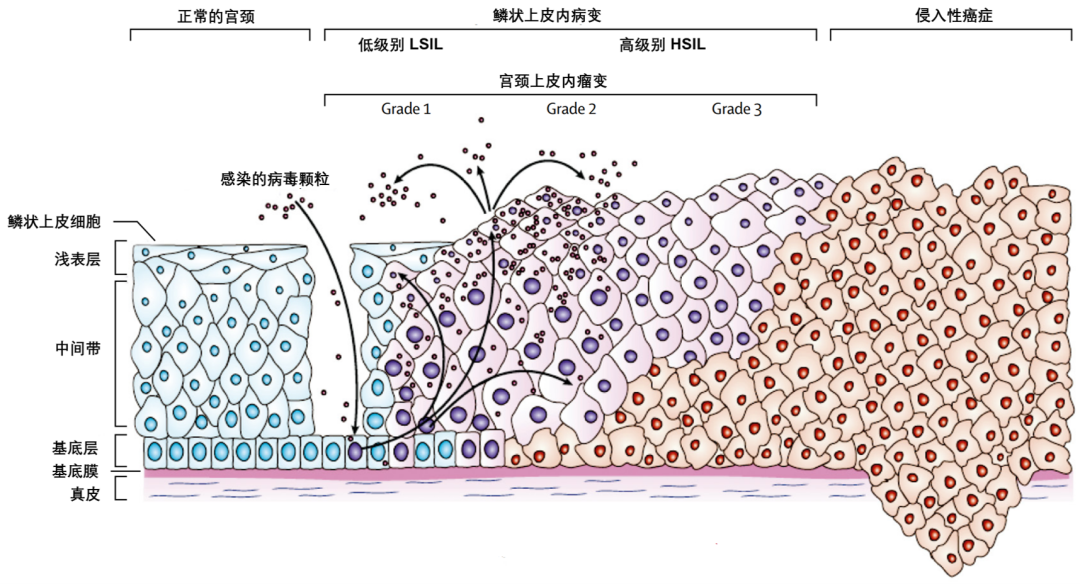
图 10. 宫颈癌进展的四个阶段
首先,我们收集了四种宫颈组织,包括病理诊断阴性(非癌)、两种癌症病变(低级别瘤变 LSIL、高级别瘤变病变 HSIL)和宫颈癌,检测了 PCDHGB7 在四种组织中的甲基化水平,发现 PCDHGB7 在癌前病变阶段,具体为高级别瘤变阶段,就已经显著高甲基化;而且 PCDHGB7 还可以进一步区分开高级别瘤变和低级别瘤变。
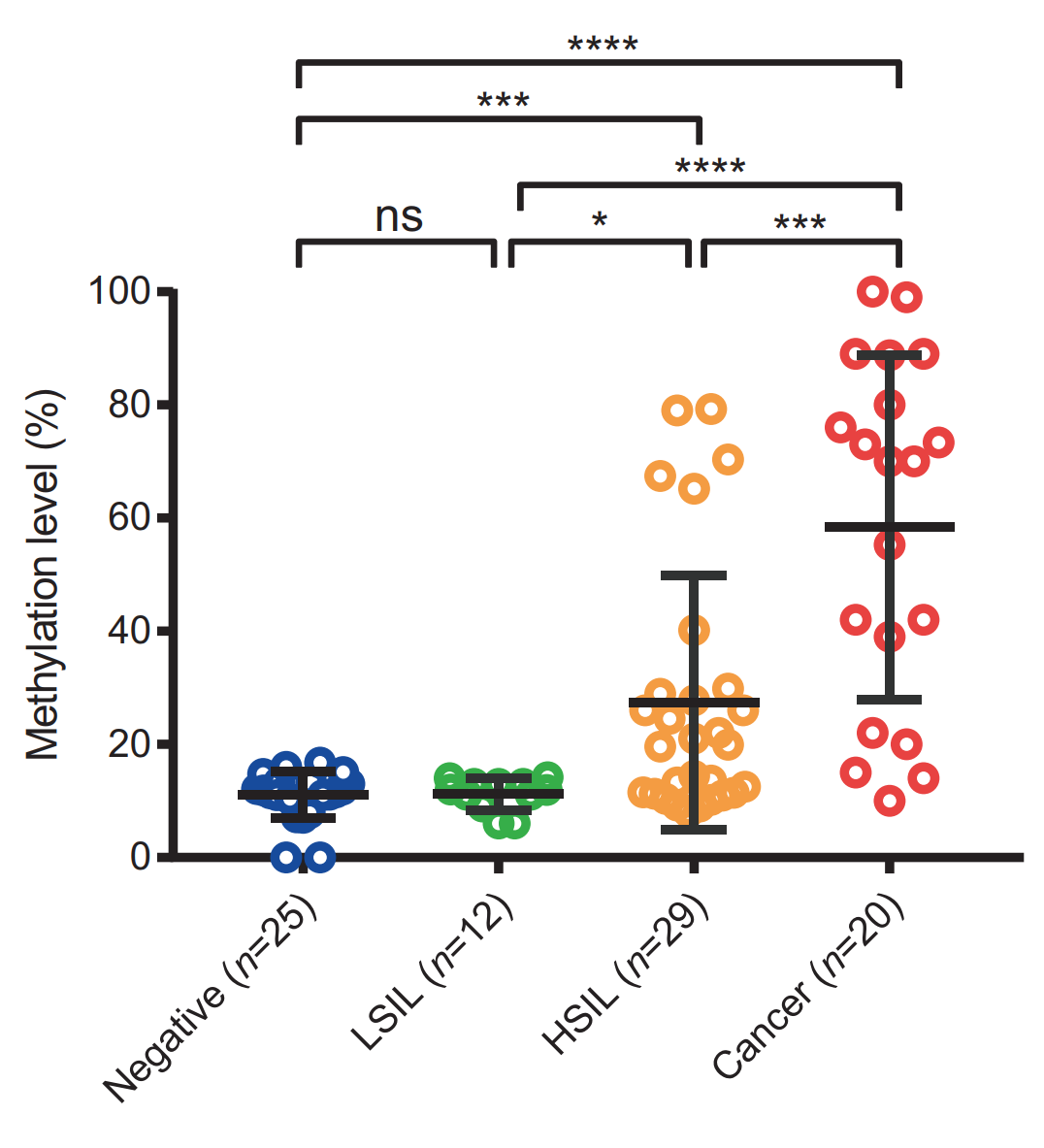
图 11. PCDHGB7 在癌前病变已经高甲基化
PCDHGB7 将宫颈癌筛查提前到高级别瘤变阶段
宫颈癌的发生是一个较长的过程,HPV 感染是宫颈癌的元凶,而高级别瘤变是最接近宫颈癌的阶段,临床一般会采取手术干预。为了全面评估 PCDHGB7 在宫颈癌中的表现,我们收集了宫颈刮片并利用上海奕谱生物有限公司独创的 ME-qPCR 检测 PCDHGB7。在宫颈刮片中也得到与此前相似的结论,PCDHGB7 在高级别瘤变阶段 HSIL 就可以被鉴定出来,进而可以有效地干预,提高患者的生存率。利用高甲基化的 PCDHGB7 作为标志物,发现检测高级别瘤变 HSIL 的 ROC 曲线下面积 AUC 为 0.87,检测宫颈癌的 AUC 为 0.97,检测高级别病变 HSIL 或宫颈癌的 AUC 为 0.88。AUC 是评价标志物的效能的重要指标,越接近 1 表示其性能越优异。由此可见,PCDHGB7 对于宫颈癌的早期检测是一个非常有效的标志物。
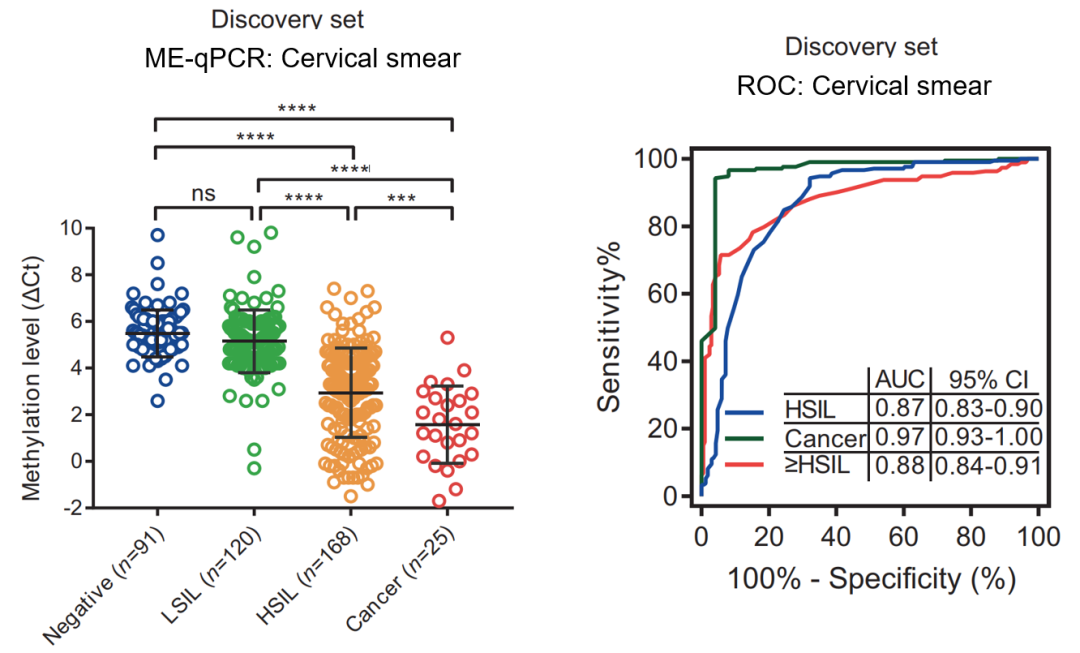
图 12. 评估 PCDHGB7 在宫颈癌早期检测中的效力
在训练集中检测后,我们又在独立的验证集中进行验证,并计算了其敏感性和特异性。对于检测高级别瘤变 HSIL,特异性为 88.7%,敏感性为 73.7%;而对于检测宫颈癌,特异性同为 88.7%,敏感性高达 100%。这些结果说明 PCDHGB7 在宫颈癌的早期检测中表现优异。
HPV 高危型病毒的感染给广大女性的生活造成了极大的困扰,事实上只有约 15% HPV 感染的女性会罹患宫颈癌,而且需要很长的时间,因此 HPV 感染造成的过度医疗是目前宫颈癌预防的突出问题。全癌标志物可以将宫颈癌的筛查提高到高级别瘤变阶段无疑具有重要意义。通过全癌标志物的检测既可以减少女性的对 HPV 感染的焦虑,也可以有效防止锥切等过度医疗手段的实施。
肿瘤的早诊早治已是共识,全癌标志物将宫颈癌的筛查提前到 “未癌” 阶段,我们有理由相信全癌标志物将为全球 2030 年消除宫颈癌提供一个可执行的中国方案。
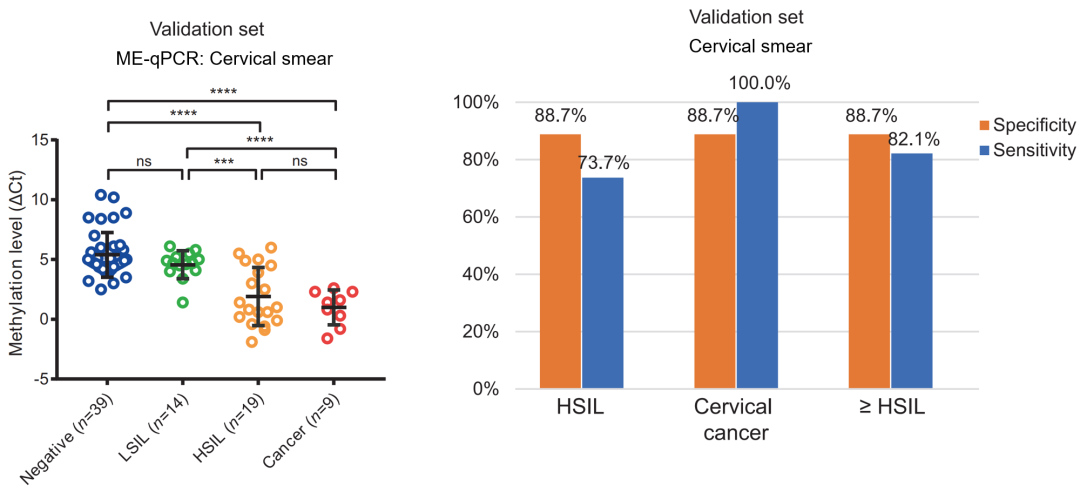
图 13. PCDHGB7 是个非常有效的宫颈癌标志物
阴道分泌物取样开启宫颈癌居家筛查新范式
宫颈刮片是一种微创的样本来源,而且必须由妇产科专科医生取样,而阴道分泌物是一种无创的样本,女性可居家自采样。如果能够检测阴道分泌物中的 PCDHGB7 的甲基化,这不仅是实现宫颈癌居家检测的第一步,也为女性有尊严的进行宫颈癌的有效筛查奠定了基础。我们收集了 273 例不同宫颈癌病变阶段的阴道分泌物。让我们感到吃惊的是,利用阴道分泌物对宫颈癌进行筛查,在 90.4% 特异性的情况下,敏感度高达 90.9%,我们的结果再一次证明全癌标志物可以让宫颈癌筛查简单、居家、快捷、易行。
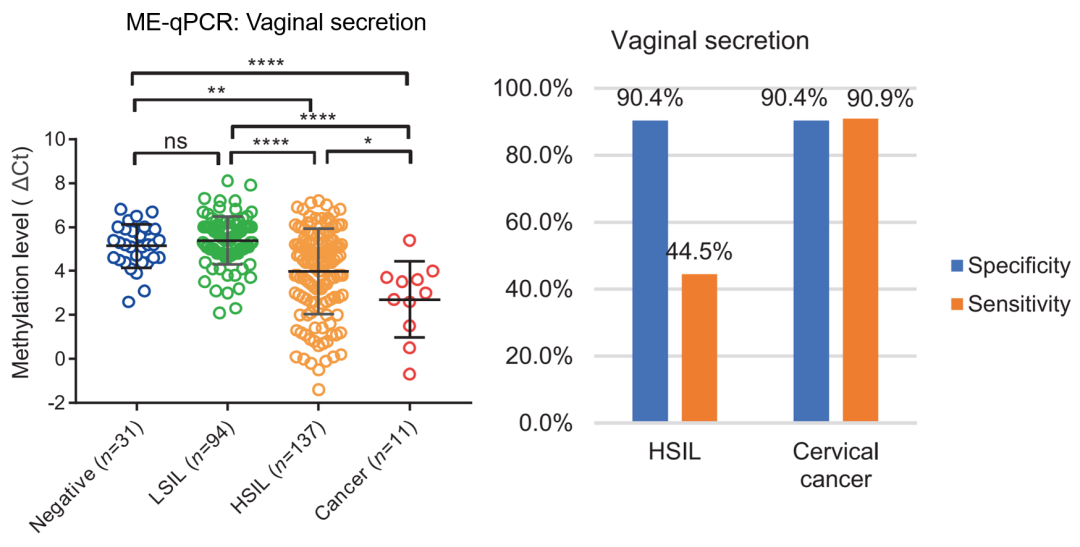
图 14. 检测阴道分泌物 PCDHGB7 可用于宫颈癌早筛
全癌标志物的思考
DNA 甲基化标志物受到越来越多的关注,各种类型的标志物层出不穷,但如前所述,不同类型的肿瘤有不同的标志物,同一种肿瘤有好多种标志物,让人眼花缭乱。早在 2000 年,麻省理工的 Robert Weinberg 就总结了癌症的六大特征 [9];2011 年,他进一步将癌症的特征总结为 10 种 [10],癌症的十大特征已成为全球癌症研究者的共识和理论基础。既然不同类型的癌症有一系列共同的特征,那么是否也存在共同的标志物呢?这是我们的基本设想。
全癌标志物的发现证实了我们的设想,我们不需要通过多种标志物的排列组合或者复杂的建模,用一种标志物检测多种肿瘤,实现一次检测可以将肿瘤一网打尽。全癌标志物研究才刚刚开始,有一系列问题尚待解决,比如:1)除了这两个全癌标志物,还有多少个呢?2)全癌标志物是否提示癌症具有统一的发病机制呢?对这些问题的回答,就进一步推动肿瘤标志物研究的进展,最终让患者受益。
全癌标志物随想
全癌标志物让我们美梦成真!全癌标志物自诞生那天起就颠覆了我们对肿瘤的认知:1)全癌标志物用一种标志物可以实现所有肿瘤的检测,让肿瘤检测简单易行,让需要高昂费用的多位点多纬度肿瘤筛查换了个马甲飞入 “寻常百姓家”;2)全癌标志物可以实现宫颈癌的超早期甚至到高级别瘤变阶段,让防癌于“未癌” 美梦成真;3)全癌标志物的筛查简单易行,结合两癌筛查的分级诊疗,实现全球消除宫颈癌我们成竹在胸,中国方案在路上;4)全癌标志物的发现提示所有肿瘤有共同的发病机制,以全癌标志物为切入点揭示肿瘤共同机制,我们有的是信心;5)全癌标志物的检测能够做到精准稳,From Bench to Bed,看似简单的事情一点也不简单,可重复 80% 靠的是你的灵气,可重复 100% 靠的是你的底气;6)全癌标志物,中国的标志物,世界的标志物。有了全癌标志物,我们就可以实现肿瘤的全流程监测,“让人人远离癌症”不再是一句口号,让梦想之光照进现实。全癌标志物,使命在肩,全癌标志物,任重道远,全癌标志物让一切不可能变为可能!
全癌标志物的研究大幕已经拉开,技术方法已经成熟,让我们期待它在癌症早期检测中大放异彩!
关于奕谱生物
上海奕谱生物科技有限公司作为全癌早筛的倡导者和开拓者,是一家专注于肿瘤 DNA 甲基化分子诊断,聚焦精准诊疗产业的高新技术企业,依托顶尖的表观遗传专家团队,凭借深厚的学术积累,智造引领时代的崭新技术产品,只为将癌症消灭于萌芽之中!奕谱生物深耕癌症筛查领域,秉承 “让人人远离癌症” 的使命,致力于癌症的早发现、早诊断、早治疗,以提高癌症患者生存率为己任,实现全民健康!
参考资料:
- Sung, H., et al., Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin, 2021.
- Ferlay J, et al. Global Cancer Observatory: Cancer Today.Lyon: International Agency for Research on Cancer;2020. Available from: https://gco.iarc.fr/today.
- 郑荣寿, et al., 2000—2014 年中国肿瘤登记地区癌症发病趋势及年龄变化分析. 中华预防医学杂志, 2018. 52(6): p. 593-600.
- Yong, W.S., F.M. Hsu, and P.Y. Chen, Profiling genome-wide DNA methylation. Epigenetics Chromatin, 2016. 9: p. 26.
- Li, J., et al., Guide Positioning Sequencing identifies aberrant DNA methylation patterns that alter cell identity and tumor-immune surveillance networks. Genome Res, 2019. 29(2): p. 270-280.
- 徐鹏 and 于文强, 给 DNA 甲基化检测装上 GPS,看肿瘤细胞如何变花样. 自然杂志, 2019. 41(05): p. 325-334.
- Dong, S., et al., Histone-Related Genes Are Hypermethylated in Lung Cancer and Hypermethylated HIST1H4F Could Serve as a Pan-Cancer Biomarker. Cancer Res, 2019. 79(24): p. 6101-6112.
- Dong, S., et al., Hypermethylated PCDHGB7 as a universal cancer only marker and its application in early cervical cancer screening. Clin Transl Med, 2021. 11(6): p. e457.
- Hanahan, D. and R.A. Weinberg, The hallmarks of cancer. Cell, 2000. 100(1): p. 57-70.
- Hanahan, D. and Robert A. Weinberg, Hallmarks of Cancer: The Next Generation. Cell, 2011. 144(5): p. 646-674.

Epigenetics 表观遗传学
表观遗传学最新进展,表观遗传学最新技术展示,表观遗传学研究相关产品应用,表观遗传学相关会议以及表观遗传学领域的风云人物介绍
101 篇原创内容

