责编丨迦溆
DNA 甲基化作为一种重要的表观遗传修饰,在调控基因的时空特异性表达方面发挥着重要的作用,包括诸如 X 染色体失活、基因组印记和重复序列抑制等重要生命过程【1】。DNA 甲基化除了在正常的生命过程中发挥重要作用,在一些疾病特别是肿瘤的发生发展过程中也扮演着重要角色【2】。
哺乳动物细胞的 DNA 甲基化主要发生在 CpG 二核苷酸对的 C(胞嘧啶)上,并在有丝分裂过程中得以相对稳定的维持,这对于细胞保持谱系特性有着重要的意义。一般来讲,DNA 甲基化的维持主要由维持性 DNA 甲基化转移酶 DNMT1 负责完成完成(朱冰课题组 2018 年的Nature论文首次在体内证实 DNMT1 可作为起始性 DNA 甲基转移酶),在这一过程中另一个重要的蛋白 UHRF1 在介导 DNMT1 发挥 DNA 甲基化维持方面也是不可或缺的。然而,由于技术的限制,DNA 甲基化维持的效率、动态及其影响因素研究得并不清楚,尽管此前有一些相关的报道【3,4】。
2020 年 6 月 24 日,中科院生物物理所朱冰研究组在Cell Research上发表了题为Kinetics and mechanisms of mitotic inheritance of DNA methylation and their roles in aging-associated methylome deterioration的研究长文,系统揭示了 DNA 甲基化维持过程中的动态过程以及精细控制分子机制,对于解释衰老或者肿瘤中 DNA 甲基化的异常变化提供了重要的分子基础。

为了研究甲基化维持的动态过程,研究人员开发了新方法Hammer-seq。其结合了 EdU(胸腺嘧啶类似物)标记新合成 DNA 链、点击化学反应在 EdU 位点添加 biotin 标签、Streptavidin 免疫沉淀以及 Hairpin 亚硫酸盐全基因组甲基化测序等技术(下图)。Hammer-seq 可以测定单个 DNA 分子内新旧 CpG 的甲基化状态,从而不仅可以测定甲基化的维持速率,还可以测定维持中可能伴随发生的从头甲基化事件。
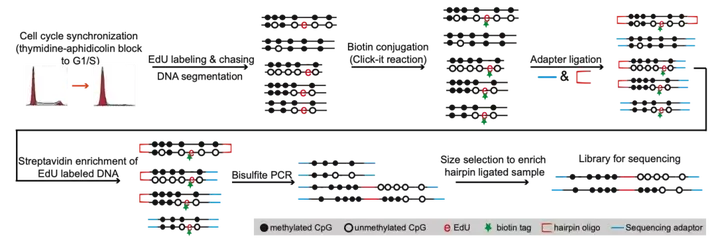
图 1,Hammer-seq 流程图。
研究发现,DNA 甲基化可以在复制叉经过后数分钟内迅速恢复到较高的水平,说明存在一个复制偶联的快速维持阶段【3,4】;而另一方面,即使复制经叉过后数小时,甲基化维持仍然在进行,说明存在一个复制非偶联的缓慢维持阶段【4】。
在朱冰组的这项工作中,研究人员系统性地突变或敲低了 DNA 甲基化维持相关的各种蛋白因子(UHRF1, DNMT1, Ligase1, CHAF1A, MCM2, LSH1 等),利用 Hammer-seq 分别鉴定了各种因子在调控复制偶联或非偶联阶段甲基化维持速率的机制。同时发现,当复制偶联阶段的甲基化维持受到了影响后,甲基化可以在复制非偶联阶段得到很大程度的维持,说明复制非偶联阶段保留了很强的甲基化维持能力。另外,具有高甲基化 CpG 密度的区域,不仅具有较高的甲基化维持速率,其从头甲基化发生频率也较高。
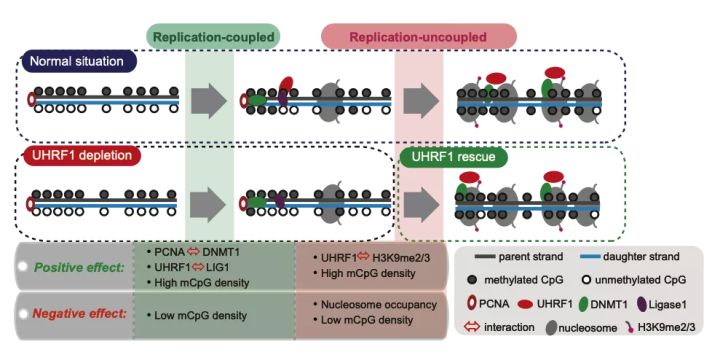
图 2,研究结果模式图。
衰老和肿瘤发生中均会发生大规模的甲基化丢失和一些 CpG 位点的甲基化水平升高【5,6】,然而其变化机制并不清楚。结合分析 Hammer-seq 的数据,研究发现,衰老和肿瘤发生中甲基化容易丢失的 CpG 位点(如 solo-WCGW 位点)表现出了较低的甲基化维持速率和从头甲基化频率。这一结果提示,甲基化维持系统的不完美性,使一些维持效率较差的 CpG 位点在不断的有丝分裂中逐渐丢失甲基化,这或许是衰老或肿瘤中多次有丝分裂带来的不可避免的后果。
据悉,朱冰研究员为通讯作者,明轩博士和张珠强研究员为共同第一作者。
原文链接:
https://www.nature.com/articles/s41422-020-0359-9
参考文献
1、Li, E. & Zhang, Y. DNA methylation in mammals. Cold Spring Harb. Perspect. Biol. 6, a019133 (2014).
2、Baylin, Stephen B., and Peter A. Jones. “Epigenetic determinants of cancer.” Cold Spring Harbor perspectives in biology 8.9 (2016): a019505.
3、Xu C, Corces VG. Nascent DNA methylome mapping reveals inheritance of hemimethylation at CTCF/cohesin sites. Science 2018; 359:1166-1170.
4、Charlton J, Downing TL, Smith ZD et al. Global delay in nascent strand DNA methylation. Nat Struct Mol Biol 2018; 25:327-332.
5、Field, A. E. et al. DNA methylation clocks in aging: categories, causes, and consequences. Mol. Cell 71, 882–895 (2018).
6、Klutstein, M., Nejman, D., Greenfield, R. & Cedar, H. DNA methylation in cancer and aging. Cancer Res. 76, 3446–3450 (2016).
https://zhuanlan.zhihu.com/p/150900611

