摘自:iNature 重磅|史上最全的基因组学概述(值得收藏)
三维基因组学是以研究真核生物核内基因组空间构象,及其对不同基因转录调控的生物学效应为主要研究内容的一个新的学科方向; 也是后基因组学时代研究的一个热门领域。它的研究重点是空间构象与基因转录调控间的关系。通过三维基因组学技术,科学家将能对基因组的折叠和空间构象、转录调控机制、复杂生物学性状、信号传导通路和基因组的运行机制等一系列重要问题进行更深入的探讨和研究,为系统解读生命百科全书和精准生物学的实施奠定坚实基础。本文综述了目前三维基因组学研究领域中的主要技术、研究现状、科研进展、存在问题、未来及与精准生物学的关系等内容。以期能较系统地展示三维基因组学取得的一系列成果,解读从三维空间构象信息到不同基因功能研究的路径,精准决定在转录调控网络中不同基因表达的时空特异性的可能模式。
三维基因组学源自人们对真核细胞核内DNA的物理长度( 在大多数哺乳动物细胞中约为2 米)与细胞核直径( 在大多数动物细胞中约为8 ~ 20 微米) 在空间与复杂功能方面不对称现象的困惑: 在一个狭小致密的细胞核内,DNA 是如何完成折叠组装成染色体? 在动态时空范围内,DNA 是如何准确的把遗传信息转录成为RNA,调控相对应的蛋白质的翻译,全程保证细胞特异性的时空表达模式的准确并完成相对应的生物学功能? 这些疑问长期以来一直困扰着生物学家们[1-4]。然而,由于技术条件的限制,相关研究在本世纪前仅限于染色体的形态观察,零散的描述和一些间接的检验性工作。
本世纪以来,分子生物学技术获得了长足的展,“人类基因组计划”( human genome project,HGP) [5] 和“人类基因组百科全书计划”( encyclopedia of DNA elements,ENCODE) [6] 的完成,为这些问题的深入探讨和研究提供了坚实的基础; 而随着一系列新的、不同类型的DNA 和RNA 被揭示和解读出来,它们同蛋白质在转录、翻译等生物学过程中是如何进行信息传递,相互协作,从而通过不同的表达调控模式去完成精准的、具有时空特异性的细胞/生物个体功能,开始成为科学家们新的挑战。随之而来的是,基因组学的研究重心开始从基因组注释转入从基因组水平探寻不同基因间相互分工与协作的分子机制层面,即三维空间结构内不同基因与非编码转录调控元件间的相互作用,及它们对目的基因在特定细胞/生物个体表达调控的生物学效应方面,也即是三维基因组学领域[7]。
三维基因组学的研究重点是解析细胞/生物个体的基因组DNA 在细胞核内的空间结构和构象,以此为基础探讨不同类型的转录调控元件与基因间的互作( 协作) 关系,构建细胞/生物个体的转录调控网络谱,并进一步揭示这些不同的互作( 协作) 关系是如何对基因的时空特异性表达模式产生影响,从而阐明基因功能和动态时空转录调控的分子机制,实现精准基因调控,它是一门从全基因组水平出发研究精准转录调控的新兴生物学科门类[8,9]。三维基因组学的迅速发展促使科学家们在其诞生6 年后( 2015 年) ,就开始正式实施了一个全新的全球合作项目———“4D 核体计划”,科学家们计划用5 年或更长的时间从空间( 三维) 和时间( 第四维度) 角度来研究细胞核结构形成原理,探索细胞核组织对基因表达、细胞功能,以及对发育和疾病发生、发展的影响[7]。因此,为更好地了解三维基因组学这一新,兴学科,本文将从技术发展、特征、应用、与精准生物学的关系等几个方面,对三维基因组学近年来的研究概况进行简要综述,以期为三维基因组学的进一步研究提供有力的理论基础和新思路,促进精准生物学的发展。
1. 三维基因组学的诞生及其主要技术
不同于传统生物学中的研究对象是从“原核生物→真核生物”,按照从“简单模式生物→高等生物”的研究模式,三维基因组学从诞生最初的研究对象就是小鼠和人。2002 年“人类基因组计划”( HGP) [5]和2011 年“人类基因组百科全书计划”( ENCODE) [6]的完成,使得科学家们可以深入排列、解读和注释基因组中不同序列的特征与功能,包括编码序列、非编码序列、转录本、非编码RNA、微小RNA、转录调控元件、增强子、绝缘子、沉默子、转录因子结合位点和粘性蛋白结合位点等,此外,超级增强子等一系列新的名称或创立或有了新的内涵[6]; 与此同时,科学家们意识到,基因组在空间结构上并不是在染色体上呈线性地一字依次排开,其三维空间结构( three dimensional,3D) 对DNA 复制、基因转录调控、染色质浓缩和分离等基本生物学过程有着重要的影响[4]。而就在同一时间( 2002 年) ,3C 技术的发明使得利用分子生物学手段研究两个目标基因间是否存在相互作用成为可能,这也为三维基因组学的产生奠定了坚实的理论基础[10,11]。2009 年ChIA-PET[12]和Hi-C[13]技术被成功发明,这两项技术使科学家们可以从全基因组水平开始研究不同基因与转录调控元件间的相互作用,这成为了三维基因组学发展过程中的里程碑性事件( Fig. 1) ,这也标志着三维基因组学时代正式来临。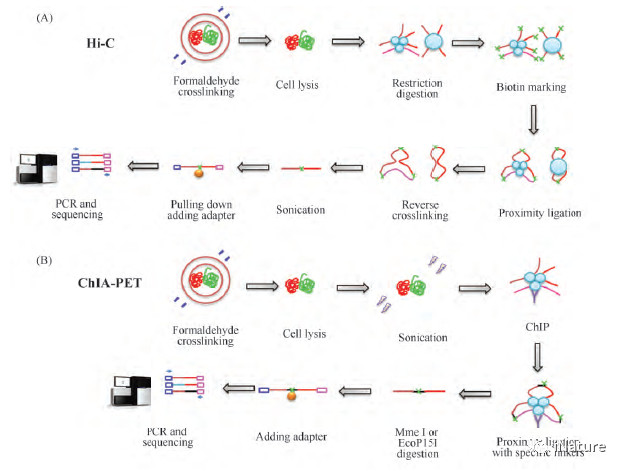
图1.Hi-C和ChIA-PET流程的简要步骤概括
近年来,有关三维基因组学研究的技术和工具的创新层出不穷( Fig. 2 ) 。以3C 技术为基础的4C[14]、5C[15]、原位连接In situ Hi-C( 2013) [16]、单细胞Single-cell Hi-C( 单细胞Hi-C 技术) [17]、杂交探针Capture-Hi-C ( 2014 ) [18]、高效酶切DNase Hi-C( 2015) [19]、高效酶切与杂交探针结合的DNaseCapture-Hi-C[19],以及原位连接与高效酶切结合的in situ DNase Hi-C( 2016) [20]和单细胞Hi-C 技术[21]被相继发明,本团队也开发出了高效的、可重复性好的eHi-C 技术( 专利申请号201610995880. X 和201710773996. 3) 。这些系列的研究结果表明,在细胞核内,含有一个或多个基因和调控元件的DNA 可以被空间上分隔开来形成拓扑相关结构域( topologically associated domins,TAD) [22],染色质上结构开放或闭合的区域,可以交替的形成功能相关的A/B 隔室[13,22]; 由于随机碰撞,两个远距离的基因位点将以较高的频率彼此对远端调节元件进行识别,从而实现远距离转录调控的成环( Loop) 空间构象,进而形成复杂的网络结构[23,24]。这些系列研究进展表明,染色质是在核内以分级形式有序折叠而形成的特定空间构象。
与此同时,以ChIA-PET 技术为基础的ChIPLoop、PLAC-seq[25]、HiChIP [26] 及Long-read ChIAPET[27]等不同技术也成功被应用到相关的研究领域中,这些研究通过特定转录因子/基因所介导的远程互作,发现了大量决定细胞身份和状态的不同转录调控元件、增强子与基因间的互作,构建了细胞内转录调控网络[3,28-31]( Table 1) 。此外,随着研究工作的不断深入,有关全基因组RNA-蛋白质互作捕获技术也被研发出来,如RIP-seq[32]和CLIP 系列技术,主要包括HITS-CLIP、PAR-CLIP、iCLIP、CRAC( CLIP 纯化升级) 等[33,34]( Table 1) 。最近,全基因组DNA-RNA 互作捕获技术GRID-seq[35]也被研发出来,该技术可以提供最详细启动子-增强子-调控RNA 的最接近转录真实情况的核内基因组三维互作图谱,为研究全局DNA-RNA 提供了可能性。基于Crisper-CAS9 的多色荧光标记CRISPR 技术[36]和原位生物素标记的dCAS9 技术( CAPTURE) [37],已在三维基因组研究中开始应用。
目前,显微镜技术的不断革新使其在三维基因组学研究中始终占有一席之地,如最新研发的断层电镜扫描联合标记技术( ChromEMT) [38]。科学家们通过筛选不同的染料,最终获得能够被精确操作,并使DNA 的局部结构和3D 聚合物结构能够在活细胞中被成像显示的染料,随着分辨率达到30 纳米的光学显微镜的成功研发,通过将染色质染料与电子显微镜断层摄影技术结合,发明了ChromEMT 新技术[39],这些技术使科学家们在超高分辨率的视野中直接对基因组的三维空间结构进行观察,以及让休眠期和有丝分裂阶段细胞的染色质结构,被高清晰的可视化。由此可以预见,在未来的几年中,这些研究进展将极大的推动“4D 核体计划”的顺利实施,也必将极大地提升科学家对全基因组空间构象与基因转录调控关系的认知。
2 三维基因组学的特征
2. 1 空间结构和三维转录调控研究
在三维基因组学产生之前,有关染色质空间结构或基因互作的研究手段主要是基于低通量的生物或物理技术。如DNA-FISH[10]、染色质的核型分析[36]、酵母双杂交[37]、免疫共沉淀[38]、蛋白质谱分析[22]等技术。这些技术的共同特点是对前期工作要求较高、操作繁琐、背景噪音比较高和不能较直接获取不同基因间的互作信息[23]。三维基因组学技术则摆脱了这些限制,它们使得科学家在没有预先工作基础的前提下,高通量的直接获取不同基因与转录调控元件的DNA 序列和互作信息,由此科学家们能对染色质空间构象、基因组三维结构对不同基因转录调控的分子机制等新领域进行研究。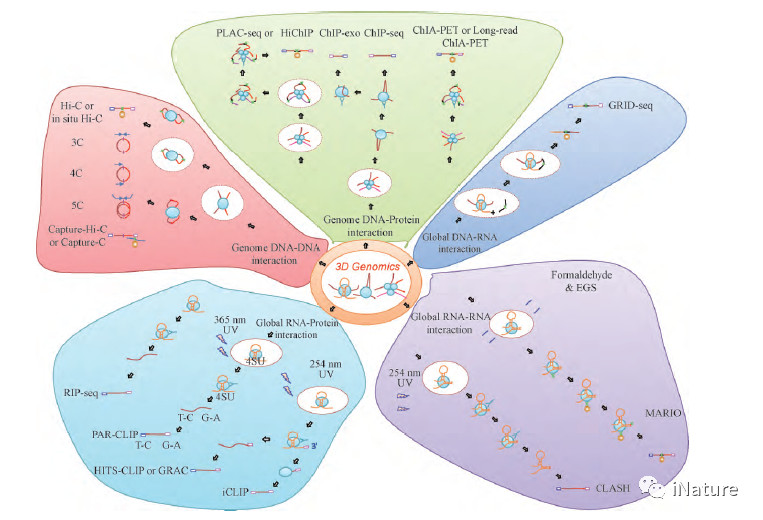
图2.不同的三维基因组技术发展过程
其中,Hi-C 技术以“全对全”模式揭示全基因组范围内不同基因与转录调控元件间的互作关系,对染色质内全部DNA 元件相互作用模式进行解析,构建基因组三维空间结构[13]; 成为了三维基因组学技术的典型代表。该技术的应用已成功定义了染色质疆域( chromosome territories ) 和染色质区隔( chromatin compartment ,包括活跃或非活跃区) ,构建了1Mb 分辨率条件下的基因组三维结构[13]。在此基础上,Bing Ren 团队界定拓扑相关结构域( TADs) 及其大小; 进一步研究了该区域与结构蛋白因子CTCF ( CCCTC-Binding factor ) 间的协作系[40]; 对有相对动态变化的sub-TAD 进行了深入研究,并提出了染色质环( chromatin loops) 的概念,被认为是基因调控的最小单元[41]。
而ChIA-PET 技术在全基因组范围内,鉴定了目标基因或转录因子与不同DNA 元件间功能相关的互作关系,有助于直接解读不同互作的同一基因特异性时空表达模式间的联系,解读复杂的生物学性状[12],如Zhang 等人在2013 年报道,利用ChIAPET技术,通过识别RNA 聚合酶Ⅱ的特异性抗体,研究揭示了3 个不同细胞系中40 000 个远距离互作增强子-启动子[3]。通过RNA 聚合酶II 和CTCF介导的ChIA-PET 数据,研究人员成功绘制了以启动子为中心的全基因组互作图谱,构建了全基因组范围内的转录调控网络; 并成功把不同基因组学或基因功能数据同三维基因组学数据进行了整合系统分析,成功揭示了一系列与癌症[12,42]、血液疾病[43]、非编码RNA 功能[44]、性别决定[45]、机体免疫[46,47]的复杂性状相关,并在基因三维转录调控方面的重要分子机制。毫无疑问,这些最新的进展为进一步研究真核生物基因组三维转录调控网络打下了坚实的基础,而在未来,三维基因组学的研究将较集中的体现在基因三维网络构建、互作类型的定义、关键转录因子/调控元件的挖掘、基因互作对细胞/生物个体的生物学效应等方面[24]。
2. 2 多组学数据整合
三维基因组学研究的主要内容是基因组的空间构象,通过研究不同基因与转录调控元件之间的空间结构关系,揭示不同基因与转录调控元件之间的相互协作关系; 简而言之其主要内容就是揭示基因组内不同元件间的相互关系,“关系”,即空间结构,是其研究的核心出发点[48]。为了准确评估或分析基因组内不同元件间的相互关系对不同基因功能的影响或生物学效应,以及揭示基因的转录调控过程,需要对特定基因转录调控过程中涉及的不同基因、转录调控元件或其他生物大分子的生物学效应进行详细注释,并通过动态时空的生物学过程,对空间结构的生物学效应,即下游的RNA转录表达模式,蛋白质翻译调控水平,进行深入的分析研究。即对研究三维基因组的空间结构以及它们对不同基因转录调控的影响的过程中,需要整合一些其他不同类型的组学数据,在全基因组范围内对不同元件进行界定和注释; 只有结合时空动态的生物学过程,科学家才能准确和深入的进行下一步有关基因互作与基因功能之间关系的解读工作[3,48,49]。目前,基因组中的基因表达和基因注释相关的数据经常被用于这类分析工作,如揭示基因组内基因表达水平的RNA-Seq 数据,鉴定不同核小体性质或转录因子结合位点的ChIP-Seq 数据,以及指示全基因组范围内可能有生物学意义的GWAS( genome-wide association study) 数据等[49]。这些研究工作同三维基因组学数据的整合,加深了人们对现有基因功能和作用模式的理解与认识,为基因功能的研究开辟了新的途径。
3 三维基因组学的应用
3. 1 解读基因功能
在三维基因组学出现之前,有关基因功能研究的主要手段是基因敲除、基因敲降、基因融合、抑制或增强基因表达和群体性状的关联分析等[50]。相关工作的进展或成败主要取决于能否观察到基因表型或生物性状的变化,如观察不到相关性状变化,研究工作就会暂停或中止; 这些研究工作的对象仅集中在基因本身,有关基因功能上下游通路或不同基因间相互协助的研究工作,主要是基于不同的实验假说或非直接证据的支持。例如,2008 年Chen 等报道,通过整合13 种不同转录因子在胚胎干细胞基因组中的结合位点,他们找到了一系列与基因转录调控活性相关的结合位点,该工作为基因功能和基因组注释提供了新的途径,得到了科学家们广泛的关注[51]; 但是由于缺乏这些结合位点同目的靶基因的相互作用关系,加之技术条件方面的限制,该研究结果并未被广泛地用于基因功能的研究。
在三维基因组学中,不同基因/转录因子与调控元件间相互作用模式的鉴定,将为类似研究的进一步深入扫清障碍,例如在人的红细胞中,研究人员发现在缺少GATA1 基因的条件下,β-球蛋白启动子区可以通过与控制位点( locus control regions,LCR) 互作增强基因的表达[52]; 进一步的研究表明,通过LCR 和γ-球蛋白形成互作,可以把胎儿时期的γ-球蛋白的表达水平提升至总球蛋白水平的85%[53],上述结果表明,由三维空间结构主导的基因互作可以决定发育途径或命运[50]。通过确定这些结合位点与目标靶基因间的相互联系,科学家可以对动态时空条件下转录调控模式的开启/关闭,基因表达水平的高/低进行进一步深入地研究,而这也为基因功能的研究开辟了一条崭新的途径。
3. 2 关键转录因子或基因的挖掘
全基因组空间构象研究的最终目标是为了深入研究基因功能,为后续实验或分析提供指导或研究线索。作为细胞/生物个体遗传功能信息的携带者,基因功能或转录调控模式的研究一直是科研人员关注的焦点,特别是对细胞/生物个体的生物性状具有显著影响的转录因子/关键基因的功能和动态转录调控模式的研究。在获取了三维空间结构上的基因互作/协作信息后,人们利用相关数据对不同类型的基因互作/协作数据进行鉴定、分类和生物学效应评估,这些工作将有助于科研人员进一步深入研究基因互作/协助,同时这些研究结果能被再次整合进入全基因组三维空间结构中,人们利用这些数据能更好地分析鉴定在全基因组范围内不同基因互作/协作的生物学效应,也有利于确定在特定发育阶段的不同转录因子/关键基因,并在此基础上制定进一步深入的基因功能研究计划。例如,Zhang 等人在2013 年报道,通过改良的ChIA-PET 技术,在胚胎干细胞和神经干细胞构建了各自的三维转录调控网络,在这些网络印证了有关生物体/细胞可能存在着转录工厂的假说; 与此同时,一些转录因子/关键基因如Oct4、Sox2、Klf4和c-Myc 被发现存在于该网络中,而它们互作的基因和转录调控元件也被成功的鉴证[3]。
在其他不同的研究领域,如某些不同的转录因子/关键基因也引起了很多不同科学家的关注,但是它们在全基因组范围的基因互作/协助关系仍不明晰,例如肌肉细胞分化发育过程中的MyoD、Myf5[54],神经细胞发育过程中的Sox2 及Sox 基因家族[55],免疫细胞研究中的IFNs 及ILs 基因家族[56],肿瘤细胞研究中的Ras、p53[57],发育过程中的Hox基因家族[58]; 这些基因是如何同其他转录因子/基因/调控元件进行互作的? 它们相互之间是否也像小鼠胚胎干细胞那样存在着基因组范围内的转录调控网络? 它们在细胞/生物个体的动态发育阶段发挥着什么样的作用? 这些问题都有待着科学家们在未来的工作中给予持续的关注和深入的研究。
3. 3 有关增强子与超级增强子
增强子是通过远距离互作调节基因功能和转录调控的非编码DNA 元件,也是目前三维基因组学领域最为熟知的研究对象之一。它们主要位于开放的染色质区域(DNA 酶I 敏感部位或ATAC-seq 信号区域) ,可以增进基因表达,此外其DNA 序列中富含细胞特异性转录因子的结合元件,且有转录激活因子CBP/P300、组蛋白修饰酶等表观遗传调节因子的富集[59]。增强子在全基因组范围内广泛存在,具有很强的时空特异性( Fig. 3) ,通过与目标启动子远距离的相互作用来实现调控靶基因转录调控[60]。科学家长期以来对增强子的研究充满兴趣,但是由于技术和科研水平的限制,有关增强子的研究一直停留在分离和鉴定阶段,缺乏相关理论和系统性的研究支持。三维基因组学的发展为增强子研究注入了强大动力,如Zhang 等人的研究揭示了3 个不同细胞系中40 000个远距离互作增强子-启动子互作,进一步分析还表明, 40%的增强子的互作对象是其邻近的基因,并且明确鉴定了余下60%增强子的靶基因[3]。
图3.增强子在细胞中的特异性和长距离相互作用调节基因表达模式
2014 年Richard Young 团队提出了超级增强子的概念[61],他们在系统分析不同细胞/发育时期的增强子数据的基础上,鉴定了一类在生命过程中与细胞身份、细胞命运和生长周期等重要生物学过程相关的增强子簇,命名为超级增强子。这类元件可以在任意细胞中被鉴定,可定义细胞身份[62]; 对环境变化非常敏感[63]; 对原癌基因表达有重要影响;一些重要性状和疾病相关的变异大部分位于超级增强子区域; 可以形成超级增强子域并表达增强子RNA [64]。以往对超级增强子的概念存在不少争议[65],但因其满足了人们对缩小研究候选对象的需求[66,67],有关超级增强子的研究取得了暴发性的进展,如癌症的研究中把超级增强子作为一类新型的药物作用靶点[68],细胞研究中把它们作为核内微环境研究的候选者[69],免疫细胞中把它们作为发育调控的关键因子[70,71]等。然而,有关超级增强子的具体组成、调控机制、作用机制和生物学功能都有待进一步的解析; 毫无疑问,三维基因组学技术是解析这一系列问题的有力工具,它的发展将为准确揭示超级增强子调控机制的研究奠定有利的基础。
4 精准生物学与三维基因组学
精准生物学的精准主要体现在资源节约/效应最大化和准确锁定目标两方面,而这必须建立在对现有生物过程/性状潜在分子机制的深入了解的基础之上。精准生物学概念的来源引自精准医学; 其基础是建立在大数据的理论之上; 通过整合基因组、蛋白质组等组学技术和生物学过程,对于大样本群体与特定性状类型进行生物标记物的分析、鉴定、验证与应用,从而精确寻找到决定性状的靶基因,并制定个性化的改良策略,对特定性状的动态时空表达模式进行精确分类,最终实现对性状/生物个体进行修正、改良和提高的目的,这种改良/提高应该符合人类预期。近年来,科学界启动了一系列精准生物学计划。但是由于缺乏对基础基因功能和分子作用机制的认识和了解,目前进展趋于缓慢[72,73]。人们已认识到,不应仅以大数据作为精准生物学的首要因素,应该多注意功能性的信息,以及加强生物大分子作用机制在精准生物学中的作[74]。
图4.增强子 - 启动子相互作用在特定组织
三维基因组学能在全基因组范围内揭示某一基因转录调控的一般规律,在此基础上进一步明确特定基因转录过程中所需的调控元件,以及同其它不同基因间的相互协作关系,这为单一基因功能和分子作用机制的研究提供了崭新的途径( Fig. 4) [3]。最近发表在《Proc Natl Acad Sci U S A》上的研究表明,基因在与不同转录元件/蛋白质分子相互作用时,可以呈现表达/关闭等不同转录模式; 进一步的研究表明,在基因表达模式中转录元件/蛋白质分子的浓度出现变化时,基因表达水平也随之持续性地升高或降低[75]( Fig. 5) ; 该研究结果潜在表明,通过三维基因组学揭示的生物体/细胞中不同基因/转录元件之间的相互作用,可用于决定特定时空条件下的基因时空表达模式; 基因的特异性时空表达,可能取决于其相互作用的其他基因/转录元件,它们的互作模式和表达量的不同,会直接影响该基因表达水平的高低或时空特异性[75]; 因此,这些基因/转录元件不同互作引起的该基因在细胞核内表达模式的微小变化,可以直接用于精准生物学的研究工作,并会直接推动精准生物学的发展,同时为其发展提供一个新的、可供选择的途径。
5 未来展望
三维基因组学是一个新兴的研究领域,虽然近年相关的进展喜人,但是人们仍然缺乏对4D 核体的全面理解,在实验方法和计算工具上仍存在较大的改进空间,相关的技术标准仍未正式确立。其导致目前数据质量参差不齐,相关的假说和理论仍有待完善; 使用不同的研究体系以及不同的研究手段,因为缺乏检测实验操作的共同基准,而造成了研究结果间不能直接比较,例如基于断层电镜扫描联合标记技术( ChromEMT) 的研究表明,核内的三维空间结构显示核内染色质的聚集是基于染色质的浓度不同,直接否认了由Hi-C 技术提出的染色质分级结构假说,并认为这种不同浓度的聚集决定了DNA 的活性和识别机[76]。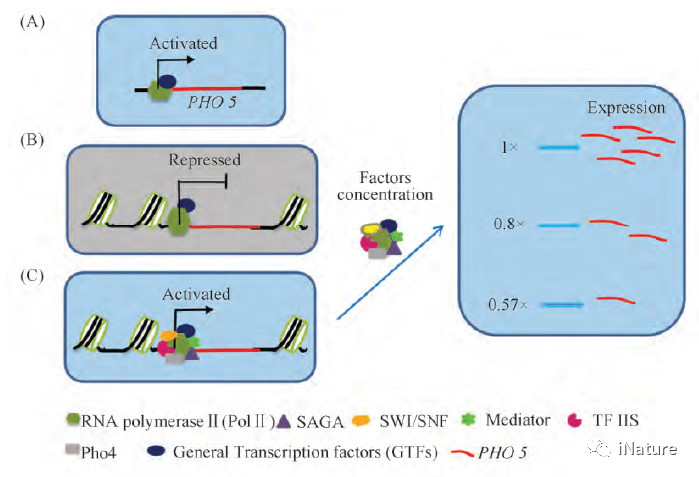
图5.基因的转录模式由不同的确定条件精确调节
目前,新技术和研究进展仍被不断地引入到三维基因组学的研究中来,如利用dCAS9 整合了蛋白质组、3C 互作和RNA-Seq 的CAPTURE 技术[77],基于单分子和单细胞原理的Multi-ChIA 技术( 会议通讯) 的研发,与此同时,研究人员整合不同类型的数据( 比如染色质互作数据和基于成像的距离测量)的能力仍十分有限,并缺乏能测量和解释不同细胞在染色体和核结构上差异的手段。上述发展均为三维基因组学的发展提供了强大的动力,同时也带来了前所未有的挑战。因而对于三维基因组学的未来发展,急需建立基于高通量技术的基因功能验证平台,通过这一平台,人们能高效的、在更大范围内和更好的验证与完善不同假说,提升和制定三维基因组学的研究标准和技术平台。而平台和标准的建立则有利于人们更有效的积累高质量的数据、信息沟通与交流、提高数据的整合效率和完善相关理论,使三维基因组学的发展进入一个良性的循环。
此外,目前在三维基因组学的研究过程中因为涉及的数据规模较大,在整合深入分析时又涉及一系列不同类型的组学数据,数据特征类型也与传统的组学数据差别较大; 以通常用的可视化工具例如GenomeBrowser、DNA Database 等不能很好的展示三维基因组学数据的内在特征和关联[78]。因此一系列新的可视化工具被开发使用,这些工具在展示三维基因组学数据时各有侧重和特点,例如热图显示( juicebox) [79]、组学数据整合( epigenome browser) [80]和疾病突变关联( 3 disease browser) [48]等。由于三维基因组数据在多维度展示不同的基因组空间构象与不同基因功能的相互联系,而目前所用工具不能明确或缺乏整合对可视化三维基因组数据在互作强度和空间构象,及基因协同作用这三个层次间的关系; 特别在用户层面,对终端科研人员的可用性和体验仍存在较大的不足,新开发的三维基因组学工具,在用户体验和可用性方面仍有较大的改进空间,上述不足有赖于在未来的工作中做进一步的完善和提升。
最后,精准生物学的发展有赖于科学家对全基因组水平上的基因功能,表达调控模式,转录翻译过程,不同基因协同作用模式等一系列基础理论的完善; 目前也缺乏对染色质构象和细胞核内生物过程( 包括转录、DNA 的复制和染色体的分离) 间关系的分子机制的清晰认识。但我们也高兴的认识到,三维基因组学的发展能为不同生物学过程的动态研究提供有力的联系桥梁和纽带,这些最基础的生物学现象与人们认知间的鸿沟可以通过高度协同、多学科整合等方式填补,其中需要擅长成像、基因组学、计算机科学以及物理学的课题组之间优势互补,通力合作。而基于分子机制的精准生物学的发展,必然会为人类社会的发展和健康医疗的完善提供更为有力的支持。
原文链接:
http://cjbmb.bjmu.edu.cn/CN/abstract/abstract24339.shtml

