ATAC-Seq分析教程系列
ATAC-Seq分析教程:ATAC-seq的背景介绍以及与ChIP-Seq的异同
ATAC-Seq分析教程:原始数据的质控、比对和过滤
ATAC-Seq分析教程:用MACS2软件call peaks
ATAC-Seq分析教程:对ATAC-Seq/ChIP-seq的质量评估(一)phantompeakqualtools
ATAC-Seq分析教程:对ATAC-Seq/ChIP-seq的质量评估(二)ChIPQC
ATAC-Seq分析教程:重复样本的处理-IDR
ATAC-Seq分析教程:用ChIPseeker对peaks进行注释和可视化
ATAC-Seq分析教程:用网页版工具做功能分析和motif分析
ATAC-Seq分析教程:差异peaks分析——DiffBind
ATAC-Seq分析教程:ATAC-Seq、ChIP-Seq、RNA-Seq整合分析
ChIPseeker
ChIPseeker虽然最初是为了ChIP-seq注释而写的一个R包,但它不只局限于ChIP-seq,也可用于ATAC-Seq等其他富集peaks注释,也可用于lincRNA注释、DNA breakpoints的断点位置注释等所有genomic coordination的注释,另外提供了丰富的可视化功能。
使用方法
使用ChIPseeker需要准备两个文件:一个就是要注释的peaks的文件,需满足BED格式。另一个就是注释参考文件,即需要一个包含注释信息的TxDb对象。
Bioconductor提供了30个TxDb包,如果其中有研究的物种就可以直接下载安装此物种的TxDb信息。如果研究的物种没有已知的TxDb,可以使用GenomicFeatures包的函数(makeTxDbFromUCSC,makeTxDbFromBiomart)制作TxDb对象:
makeTxDbFromUCSC: 通过UCSC在线制作TxDb
makeTxDbFromBiomart: 通过ensembl在线制作TxDb
makeTxDbFromGRanges:通过GRanges对象制作TxDb
makeTxDbFromGFF:通过解析GFF文件制作TxDb
制作TxDb方法示例:
如用人的参考基因信息来做注释,从UCSC生成TxDb:
library(GenomicFeatures)hg19.refseq.db <- makeTxDbFromUCSC(genome="hg19", table="refGene")
用GFF文件做裂殖酵母的注释
download.file("ftp://ftp.ebi.ac.uk/pub/databases/pombase/pombe/Chromosome_Dumps/gff3/schizosaccharomyces_pombe.chr.gff3", "schizosaccharomyces_pombe.chr.gff3")require(GenomicFeatures)spombe <- makeTxDbFromGFF("schizosaccharomyces_pombe.chr.gff3")
第1步:下载安装ChIPseeker注释相关的包
从Bioconductor直接下载,或从github安装最新版本 ```bash source (“https://bioconductor.org/biocLite.R“) biocLite(“ChIPseeker”)
下载人的基因和lincRNA的TxDb对象
biocLite(“org.Hs.eg.db”) biocLite(“TxDb.Hsapiens.UCSC.hg19.knownGene”) biocLite(“TxDb.Hsapiens.UCSC.hg19.lincRNAsTranscripts”) biocLite(“clusterProfiler”)
载入各种包
library(“ChIPseeker”) library(clusterProfiler) library(“org.Hs.eg.db”)
library(TxDb.Hsapiens.UCSC.hg19.knownGene) txdb <- TxDb.Hsapiens.UCSC.hg19.knownGene
library(“TxDb.Hsapiens.UCSC.hg19.lincRNAsTranscripts”) lincRNA_txdb=TxDb.Hsapiens.UCSC.hg19.lincRNAsTranscripts
<a name="k853a"></a>### 第2步:读入peaks文件函数readPeakFile读入peaks文件```bashnanog <- readPeakFile("./idr_out.bed/nanog_idr-bed")pou5f1 <- readPeakFile("./idr_out.bed/pou5f1_idr-bed")
第3步:注释peaks
peaks的注释是用的annotatePeak函数,可以单独对每个peaks文件进行注释,也可以将多个peaks制作成一个list,进行比较分析和可视化。
# 制作多个样本比较的listpeaks <- list(Nanog=nanog,Pou5f1=pou5f1)# promotor区间范围可以自己设定promoter <- getPromoters(TxDb=txdb, upstream=3000, downstream=3000)tagMatrixList <- lapply(peaks, getTagMatrix, windows=promoter)#annotatePeak传入annoDb参数,可进行基因ID转换(Entrez,ENSEMBL,SYMBOL,GENENAME)peakAnnoList <- lapply(peaks, annotatePeak, TxDb=txdb, tssRegion=c(-3000, 3000), verbose=FALSE,addFlankGeneInfo=TRUE, flankDistance=5000,annoDb="org.Hs.eg.db")
annotatePeak传入annoDb参数,即可进行基因ID转换,将Entrez ID转化为ENSEMBL,SYMBOL,GENENAME,peakAnnoList的结果如下:
seqnames start end width strand annotation geneChr geneStart geneEnd geneLength geneStrand geneId transcriptId distanceToTSS ENSEMBL SYMBOL GENENAME flank_txIds flank_geneIds flank_gene_distances5 chr3 196625522 196625873 352 * Intron (uc003fwz.4/205564, intron 2 of 9) 3 196594727 196661584 66858 1 205564 uc011bty.2 30795 ENSG00000119231 SENP5 SUMO specific peptidase 5 uc003fwz.4;uc011bty.2 205564;205564 0;0
第4步:可视化
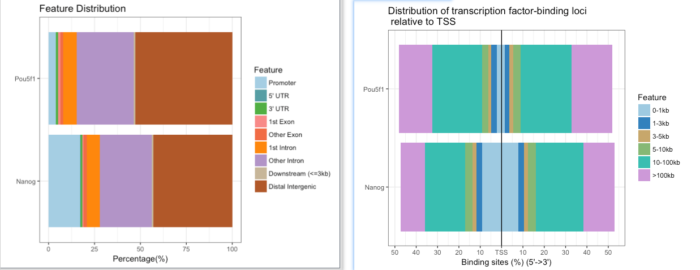
提供了多种可视化方法,如plotAnnoBar(),vennpie(),plotAnnoPie(),plotDistToTSS()等,下面展示了两个样本在基因组特征区域的分布以及转录因子在TSS区域的结合。
plotAnnoBar(peakAnnoList)plotDistToTSS(peakAnnoList,title="Distribution of transcription factor-binding loci n relative to TSS")
第5步:功能富集分析
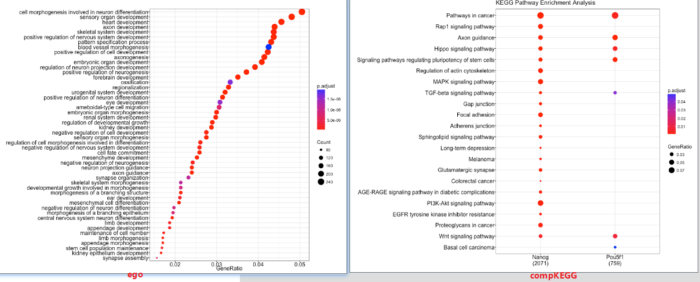
提取peakAnnolist中的基因,结合clusterProfiler包对peaks内的邻近基因进行富集注释。
# Create a list with genes from each samplegene = lapply(peakAnnoList, function(i) as.data.frame(i)$geneId)# Run GO enrichment analysisego <- enrichGO(gene = entrez,keytype = "ENTREZID",OrgDb = org.Hs.eg.db,ont = "BP",pAdjustMethod = "BH",qvalueCutoff = 0.05,readable = TRUE)# Dotplot visualizationdotplot(ego, showCategory=50)# Multiple samples KEGG analysiscompKEGG <- compareCluster(geneCluster = gene,fun = "enrichKEGG",organism = "human",pvalueCutoff = 0.05,pAdjustMethod = "BH")# Dotplot visualizationdotplot(compKEGG, showCategory = 20, title = "KEGG Pathway Enrichment Analysis")
第6步:保存文件
# Output peakAnnolist filesave(peakAnnoList,file="peakAnnolist.rda")write.table(as.data.frame(peakAnnoList$Nanog),file="Nanog.PeakAnno",sep='t',quote = F)# Output results from GO analysis to a tablecluster_summary <- data.frame(ego)write.csv(cluster_summary, "results/clusterProfiler_Nanog.csv")
- 版权声明 本文源自 生信拾光, XP 整理
- 转载请务必保留本文链接:https://www.plob.org/article/24683.html