简介
无论您对使用流式细胞仪分析哪种感兴趣的细胞,大多数分析都是从相同的基本设门策略开始的。
这些门对于清洗流式细胞仪数据至关重要,并有助于清除由于空气或阻塞而导致的异常数据、清除粘连的细胞、排除电子噪声、清除不是完整细胞的小颗粒等等。
从Time门开始
Timeime参数衡量的是每个样本获取的时间,通过Time和散射光参数(如SSC或FSC),就可以确定哪段时间出现了小气泡、小团块或样本跑光。
这很重要,因为当存在小气泡、小团块或空气的情况下,您的结果和数据可能会发生巨大变化。
例如,当微气泡通过流动室激光检测点时,气泡会沿不同方向散射和偏转荧光,使得获取的信号看起来像假阳性。
小团块是由细胞和液路里面其它物质形成的。当这些小团块破裂时,整束细胞会突然快速通过,呈现出像许多标记阳性的大细胞一样的形态。粘连体门可以排除这些细胞,但是,最好在Time门中消除这种假信号。
样品跑完时会带入空气,也会使数据看起来十分“混乱”,而这种“混乱”会极大地影响数据结果。空气产生的信号会分布在散点图的各个位置。
为了消除上述这三种假信号,建议只选择一定大小(排除过大信号)、并且液流稳定区域,例如下图左侧未设门时可以看到比较明显的液流不稳定区域错落分布,那么可通过下图右侧不规则的门,将这些区域逐一排除:
接下来呢?在目的细胞群周围绘制“松散门”
一旦使用Time门清除了与数据中的气泡、小团块和空气有关的问题,在排除特定细胞类型和颗粒时,围绕目的细胞画一个大一些的门(松散门),既可以排除不相关的细胞干扰,又避免丢失一些大小发生改变的目的细胞。
下图显示了一个在全血(左)和淋巴结(右)上绘制的松散门的示例:
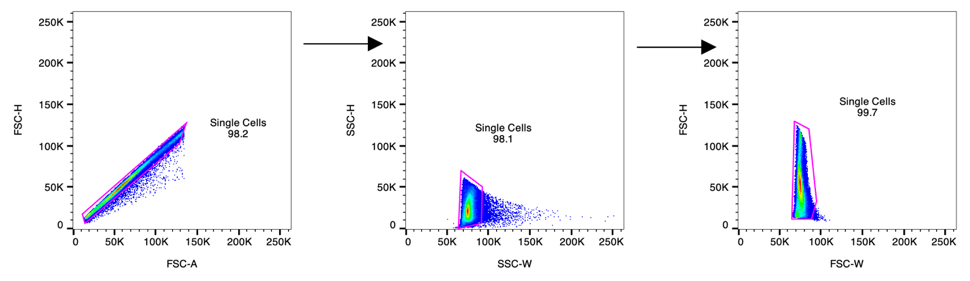
单细胞门可去除粘连体和其他粘连颗粒
完成绘制Time门和松散门之后,下一步是绘制几个门,以帮助区分两个或多个细胞穿过流动池时是否粘在一起。
一次仅分析一次通过流动室的细胞是很关键的,是因为粘附在一起的细胞可能产生你意想不到的双阳性。
例如,粘附在单核细胞上的T细胞,两者同时通过时就可能看起来像一个CD3 + CD14 +细胞,此时你可能以为发现了一种新的细胞类型,而实际上,它们是两个截然不同的细胞粘在一起穿过激光照射点,看上去像一个细胞。
以下几个参数对于消除粘连体非常有用:
- FSC-A x FSC-H
- SSC-H x SSC-W
- FSC-H x FSC-W
Live/Dead和CD45双标,是寻找目的细胞的绝佳方法
许多流式细胞术研究都是研究人类或动物模型组织的,区分白细胞和非白细胞的一种极好的方法是使用所有白细胞中都存在的CD45标记。不过在全血样本时,不用CD45标记也行,因为样本裂解之后几乎每个细胞都是白细胞。
如果要分析免疫细胞,则应在方案中加入CD45,除了区分白细胞之外,另一个原因是,基于CD45圈出的分母会更准确,有利于标准化。
Live/Dead染料能够区分死细胞和活细胞,结合CD45抗体和死活染料的例子如下,CD45+Live门是活的白细胞: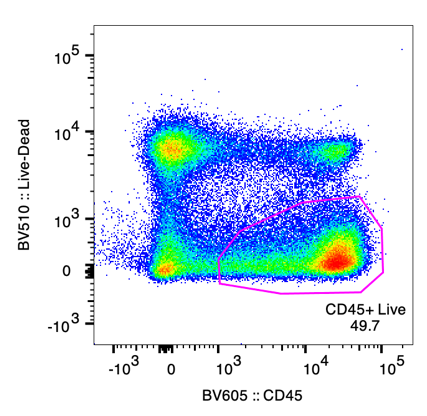
把前面三个设门方案组合在一起
把之前描述的所有门放在一起,就组成以下的设门基本策略:
Time Gate -> Loose gate -> FSC-A x FSC-H -> SSC-H x SSC-W -> FSC-H x FSC-W -> CD45+ Live
无论你是新手还是高手,这样的设门顺序,都有助于后续的单细胞分析,所以,标准化,从基础设门策略开始吧。
信源:https://marissafahlberg.com/beginner-gating-strategies-to-start-analyzing-your-flow-cytometry-data/