全光谱流式细胞术基本原理和应用
By: 李梦元 清华大学免疫所平台
Email: manuallee@163.com
1 发展
图1. 光谱流式的发展
DOI: 10.1002/0471142956.cy0127s63
在流式细胞术(Flow Cytometry)的早期使用了色散光学方法,如光栅和棱镜,将光聚集到检测器阵列上,这是仪器性能的限制性因素。早期只能测量多个微粒的平均光谱,而后来的检测器可以测量单个微粒的光谱。另一方法包括使用扫描单色仪和PMT在不同波长进行连续测量,能够获取相对高分辨率的群体平均光谱。一种干涉仪的测量方法,使得单个细胞的测量成为可能,但是其光谱分辨率较低。速度、灵敏度和光谱分辨率三者之间的权衡,极大限制了早期流式系统的性能。近年来,光学、检测器和数据系统的改进,使光谱流式仪得以发展,它可以对细胞和其他微粒进行快速的、灵敏的高分辨率检测。
多年来,多色流式一直被认为是流式的发展趋势。从单色到2色,到3色到更多。但技术从未真正改变。所做的无非就是添加更多的PMTs和选择更多的激光器。虽然这做得很好,但受到可用荧光染料的限制,使做多色流式非常困难。也许有更好的办法!
全光谱流式细胞术(Full Spectral Flow Cytometry)最初是由普渡大学(Purdue University)在2004年蒙彼利埃ISAC会议上提出的,并于2004年在《国际生物光学期刊》上发表,该方法的原理是使用连接到色散元件的32通道PMT阵列,而硬件组件减少到只有几个光学元件和一个检测器阵列。普渡大学于2007年申请专利US7280204。2011年,索尼获得了普渡大学的光谱技术专利许可,并致力于开发光谱流式细仪。
2 仪器结构介绍
传统的流式是利用双色镜和带通滤光片对发射荧光进行分割和过滤,而光谱流式通过棱镜或衍射光栅分散单个细胞的发射荧光,是一种检测单个细胞发出的荧光信号的新技术。光谱流式通过光电倍增管(PMT)或电荷耦合器件(CCD)获得完整的荧光光谱,并对来自每种荧光染料的信号进行光谱解析。类似于光谱共聚焦激光扫描显微镜,显示每个细胞的荧光光谱,识别自发荧光。因此,光谱流式有望成为光谱分析的有力工具。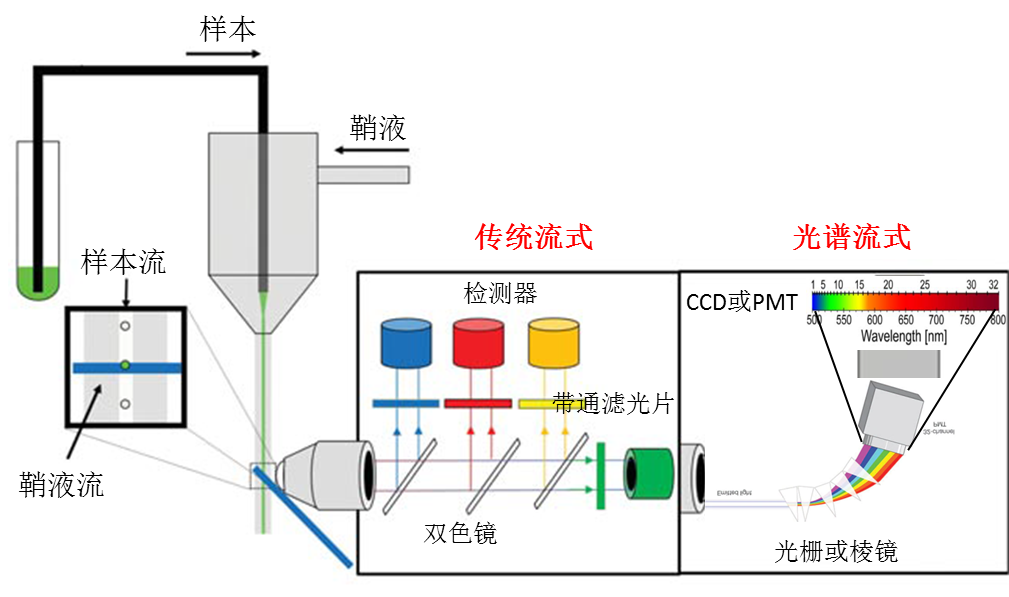
图2. 传统流式和光谱流式检测的原理比较。传统的检测方法是使用双色镜和带通滤光片来选择特定波长范围的光,进而通过PMTs检测的。光谱检测使用光栅或棱镜将光色散到检测器阵列上。
DOI: 10.1002/0471142956.cy0127s63
传统流式和光谱流式之间的第一个重要区别是色散。传统流式是根据波长来阻挡、反射或传输光子的,而光谱流式是根据波长来色散光子的。最常见的色散光学元件是棱镜和光栅。棱镜是一种典型的色散光学元件,它根据波长的不同来折射光线。棱镜的通量通常很高(>90%),色散发生在宽波长范围内,但色散是非线性的,光谱分辨率随着波长的变化而变化,通常在可见光谱中变化几纳米。光栅在特定波长下具有更高分辨率的线性色散,但高阶衍射的存在会降低效率和通量,增加杂散光。体积相位全息光栅,在他们的最佳波长,也可以提高效率和分辨率,而且杂散光的强度较低。除了色散问题,其他光学效应,如球面像差,也会影响性能。大多数商用摄谱仪的设计都是为了最小化这些问题,以提供最大的光学性能。
传统流式和光谱流式的第二个主要区别是检测器。棱镜或光栅产生的连续光谱的测量需要一个线性阵列的检测器。检测阵列的密度和间距,以及色散光学的性能,共同决定分辨率。近年来,检测技术发展迅速,目前光流式的检测器主要有CCD和多阳极PMT。
矩形设计的CCD,像素大小通常在15到30µm之间,当与高效光栅结合时,可以提供亚纳米级别光谱分辨率。这样的CCD芯片在整个可见光谱中有非常高的量子效率(> 95%),并可用在很多带有电子倍增功能的商业产品中,它提供了一个1000×增益的芯片单元。芯片单元使光谱分辨率可以用来交换增强信号,在芯片上进行读取可以最大限度地降低读取噪声,而读取噪声是CCD测量的主要背景。在流式应用中,CCD检测器的最大事件数受到像素的数量和读取速度的限制,中端检测器支持每秒数百个事件,而最先进的检测器支持每秒数千个事件。基于CCD的光谱流式已用于可见光和近红外荧光的测量,以及纳米颗粒表面增强拉曼散射(SERS)标记的测量。
多阳极PMT有较小的阵列和更大的探测器元件(每∼800µm有32个阳极),这限制了光谱分辨率。例如,300nm的光谱分散在32个检测器元件上,每个通道的最大分辨率为10nm,对于许多发射光谱比较宽的荧光染料来说是足够的。多阳极PMTs的量子效率也较低(<20%),红光波段内量子效率急剧下降。另一方面,与CCD相比,PMTs具有更高的增益和更快的速度。
3 全光谱方案设计
光谱流式增加了荧光染料选择和检测的灵活性,但仍需考虑常规流式的实验方案设计。包括先前的生物实验、仪器使用、抗原表达水平、荧光染料亮度和配色方案优化。虽然光谱流式方案的设计类似于与传统流式仪,重要的差异和额外的考虑适用于光谱流式,如下图。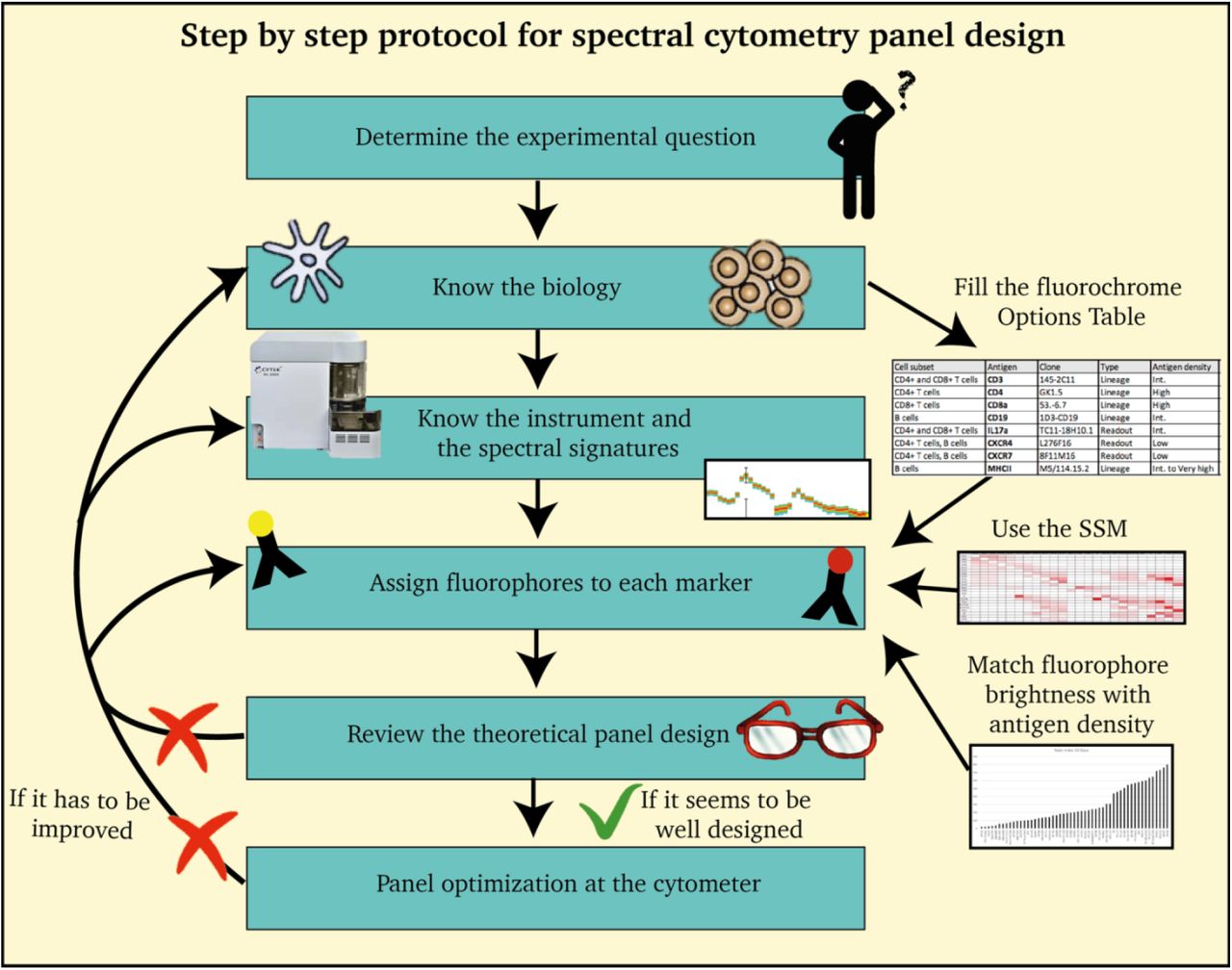
图3. 多参数光谱流式方案设计
doi.org/10.1002/cpcy.70
只有具有独特光谱特征的染料才能在同一方案上使用,具有相似光谱特征的染料有可能引入扩展误差(Spreading Error, SE),如果与互斥表达的标志一起使用,这种SE可以得到缓解。当两个光谱相似时,可以用SpectroFloTM软件计算相似性指数(Similarity Index)来评估这两个光谱的兼容性。这个指数的范围是从0到1。两个具有完全不同特性的荧光染料的相似性指数将接近于0 (例如,FITC和APC),而两个高度重叠的荧光染料的相似性指数将接近于1 (例如PerCP-Cy5.5和PerCP-eF710)。根据实验数据,两种染料的相似性指数<0.98才可以同时使用 (即,FITC和BB515)。随着更多激光和通道的加入,相同染料的全光谱特征在5激光上比在3激光上显示出更多的数据点,额外的信息可以更准确地区分相似的光谱特征。
一旦选定了一组染料,另一种度量标准,复杂性指数(Complexity Index)就会评估选定范围内所有光谱的总体相似性。复杂性指数考虑了每对染料的相似性指数。复杂性指数越低,在给定的荧光染料组合下获得最优结果的概率就越高。例如,当选择10种不同的染料,其相似度指数最高为0.3时,其复杂性指数为2.5。相比之下,如果在这10种染料中,有两种的相似度指数达到0.98,那么复杂性指数就会增加到26。
4 全光谱数据
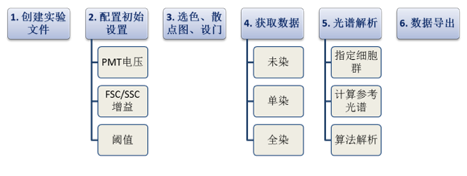
图4. 数据获取步骤,参考SP6800
光谱流式的第一个挑战是如何存储和显示数据,且与传统流式相兼容。一种方法是将每个光谱数据点存储为一个流式参数,这样用32通道多阳极PMT获得的光谱数据将以32个离散参数存储在FCS格式数据文件中。这种方法的优点是与当前的FCS文件格式标准相兼容,原则上允许任何第三方软件读取文件。这种方法的缺点是它牺牲了光谱的连续性,和以光谱的形式显示和分析数据的能力。此外,这是一种低效的数据存储方式,导致数据文件大,处理速度慢,特别是在使用CCD阵列收集光谱数据时会产生数百或数千个光谱数据点。
另一种方法是将光谱存储为光谱文件,允许它们作为连续的数据串显示和分析。这样做的优点是使复杂的光谱分析和显示相当直接,缺点是与现有的FCS文件格式不兼容,并且不支持现有的流式数据分析软件来读取这种数据格式。这就需要开发针对光谱流式特定的分析软。例如,Robinson的团队开发了一个名为Cytospec的软件包,用于分析来自32个多阳极PMT通道光谱流式的光谱数据。该软件包可以显示完整的光谱,以及一些不同的分析,包括主成分分析(PCA)。众所周知FCS文件的局限性,ISAC流式数据标准工作组一直在开发一种替代格式,将FCS格式数据和其他数据类型打包成zip格式文件。对光谱流式数据采取了类似的方法,开发了一个zip格式,其中包含FCS格式数据、文本格式光谱数据和光谱分析产生的文本格式数据。
商用流式软件(FCS Express 4, de Novo Software)开发了用于该文件格式的读取插件,允许打开zip格式并读取不同类型的数据;为了方便光谱显示和数据分析,开发了该软件的定制版本。使用这种方法,可以显示单细胞光谱或多细胞的平均光谱,以便显示传统流式设门的细胞群的光谱,应用虚拟带通滤光片光谱数据来创建新的参数,并对这些参数显示和设门。
5 光谱解析Spectral Unmixing
对于传统的流式,检测器的数量等于染料的数量。传统的流式细胞仪将每个检测通道与每个单独的荧光染料相关联(例如,FL1表示FITC, FL2表示PE),因此检测器的数量与荧光染料的数量相匹配。当从单个荧光染料(染料1)染色中获得荧光信号时,在FL1中检测到的信号被认为是“信号”,其他通道的信号被描述为“光子溢出”。来自这些其他通道的信号构成补偿计算中的荧光溢漏矩阵。
传统流式通过应用带通滤光片来测量特定波长范围的信号,可以分析单个细胞的光谱。类似的,在光谱流式中通过定义一些虚拟带通滤光片,将信号在指定的波长范围内进行积分,从而生成新的参数,以直方图的形式显示。一旦光谱数据被简化为一组新的参数,这些参数就可以作为常规数据参数来处理。
例如,使用基于CCD的系统,通过光谱流式测量的量子点(Qdot)标记的微球。图5A所示为用三个不同Qdot分别标记的单个微球的光谱。检查三个Qdots的平均光谱时(图5B),可以看出三个Qdots的光谱重叠和亮度差异。为每个Qdot定义了一个虚拟带通滤光片,且以发射波长峰值为中心,并积分计算了每个Qdot对应的发射光谱,从而创建了三个新参数,这些参数显示为直方图(图5C)。
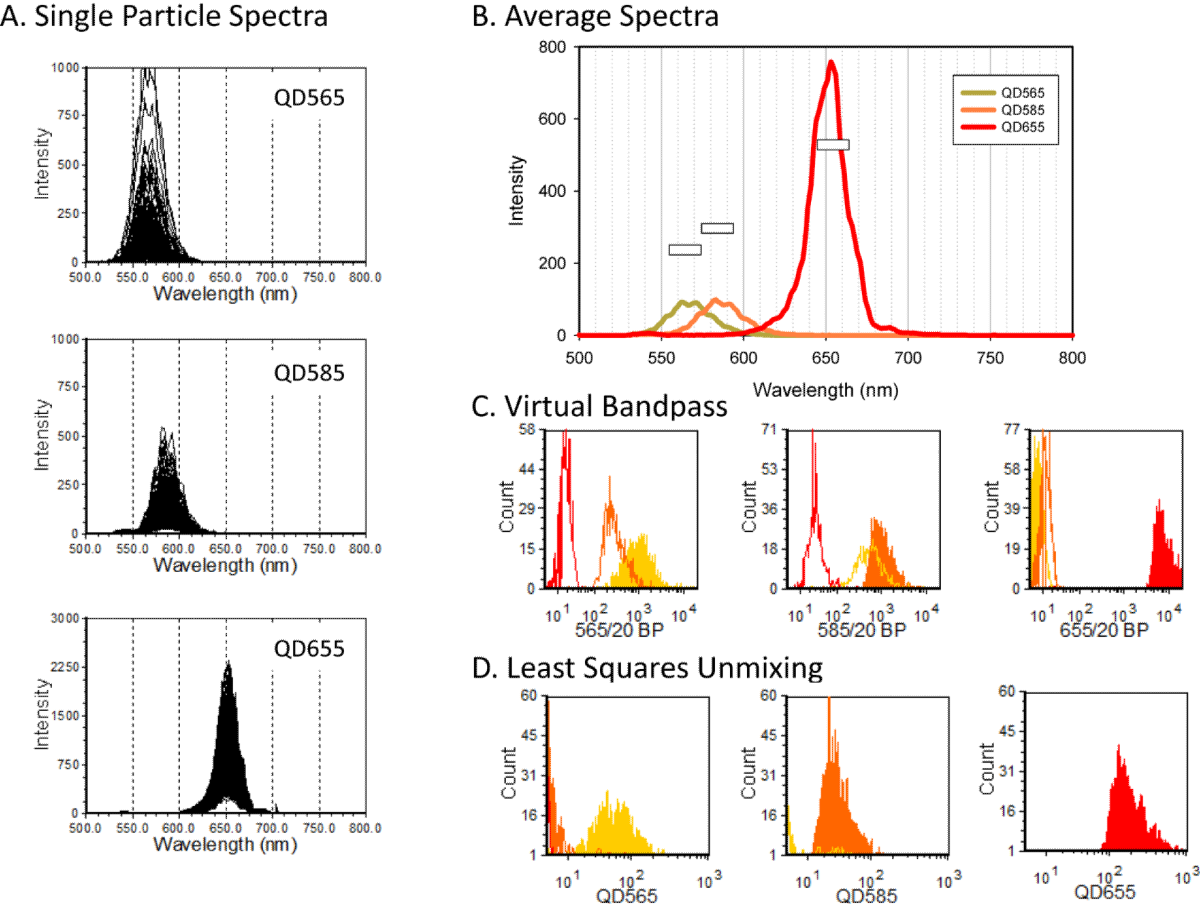
图5. 虚拟带通滤光片和光谱解析。采用流式对不同Qdots标记微球进行分析。(A)单个微球的光谱和(B)每个Qdot标记的微球的平均光谱。(C)使用虚拟带通滤光片计算的每个Qdot的信号。(D)使用LSM光谱解析计算的每个Qdot的信号。
DOI: 10.1002/0471142956.cy0127s63
与真实带通滤光片的实验一样,应用虚拟带通滤光片的光谱数据,也会面临相邻光谱间的荧光溢漏或串色。在使用带通滤光片的传统流式多色实验中,测量所有通道的单染样本,用于计算补偿矩阵,对于通道间的荧光溢漏进行数学修正。补偿也可以应用于虚拟带通滤光片的数据里。
然而,在光谱分析中,不管所分析的荧光染料的种类有多少,均收集所有检测通道的信号。光谱分析使用所有检测通道的信号,而不考虑所分析的荧光染料的种类。由于检测器的数量通常大于所分析的荧光染料的种类,所以每种染料发射光谱的测量范围可横跨从激光波长到红外波长区域。因此对于光谱分析来说,检测器的数量大于或等于染料的种类。单染样本的发射光谱被所有检测通道收集并产生信号,利用发射光谱信号创建该染料的参考光谱,进而应用于光谱解析计算。
在光谱流式中,我们可以使用单染样品的全光谱数据,通过最小二乘法解析光谱,来确定全染样本中每种染料对总光谱的贡献。在图5D中,经典最小二乘法(LSM)解析是光谱成像中经常使用的一种方法,它用来解析具有高度重叠的光谱。
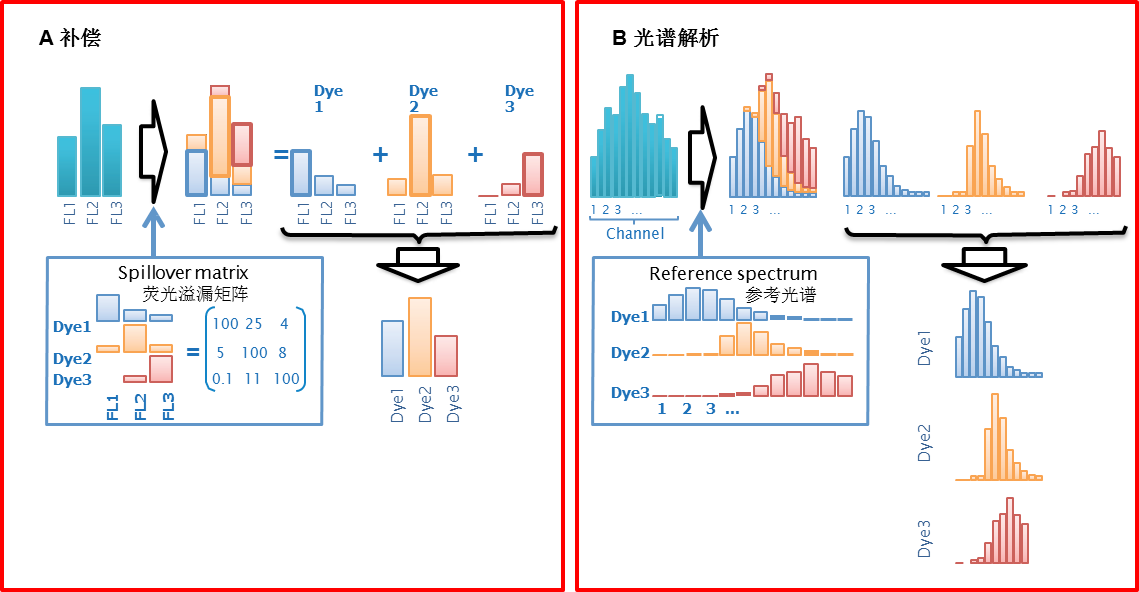
图6. 补偿与光谱解析比较 A使用荧光溢漏矩阵计算补偿 。B使用参考光谱进行光谱解析。检测到的信号为三种染料(dye1, dye2和 dye3)发射光谱的叠加,每种染料的真实信号强度被计算出来。
Spectral Unmixing with Sony Spectral Analyzers. Nao Nitta, Ph.D., Greg Veltri, Ph.D., Mark Dessing. Sony Corporation
在数学上,荧光溢漏矩阵和参考谱图是相似的,补偿和光谱解析也是一样的。图6显示了三色案例,比较了传统流式的补偿与光谱流式的光谱解析。传统流式补偿计算使用荧光溢漏数据(来自荧光溢漏矩阵)来计算实际的信号强度。在光谱分析中,三种染料的参考光谱被用来进行光谱解析计算。虽然这些计算是类似的,光谱分析使研究人员可以看到完整的发射光谱信号,而不使用带通滤光片,并使自发荧光作为一个单独的颜色处理。
5.1 经典的最小二乘法解析 (LSM)
光谱解析算法可以分为两大类:监督和非监督算法。前一算法假设各个组分的参考光谱是已知的,在这种情况下,数据分析转变为一个超定方程组的解(只要通道的数量超过荧光染料的数量),通常使用最小二乘法 (LSM, Least Square Method) 来解,LSM解析是一种广泛使用的方法;在无监督算法中,开始处理数据时,没有任何东西是预先知道的。从原始数据中同时提取各个组分的光谱及其各自的浓度分布,根据先前的假设来选择使误差或价值函数最小化,例如多元曲线分辨。
基于LSM的光谱解析,假定未知样品中参考光谱与被测光谱呈线性相关,计算各个参考光谱的贡献,类似于传统流式中补偿的数学调节。当组成被测光谱的参考光谱发生变化甚至未知时,可以使用其他光谱解析方法。
经典最小二乘法解析采用线性分解算法求解矩阵方程: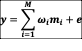
y表示被测光谱矩阵,ω 表示乘数因子矩阵,mi 表示参考光谱矩阵, e表示噪音,M表示荧光染料数目。结果是乘数因子矩阵ω的线性最小二乘法求解,它由每个细胞上的各种标记组成。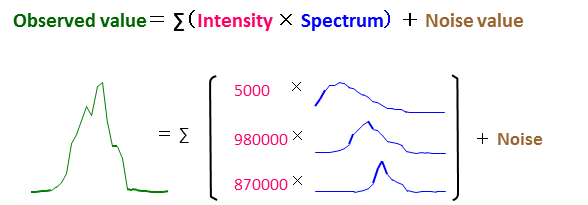
图7. 光谱解析即评估荧光强度,也考虑参考光谱
Probabilistic Spectrum Compensation for Flow Cytometry. Masashi Sekino, Yasunobu Kato, Tatsumi Ito. Sony Corporation
新的解析算法,可以同时评估每个细胞的荧光强度和发射光谱,每个荧光染料的发射光谱是由一个相应的先验分布(prior distribution)产生的,先验分布即已知的光谱形状,可由单染微球或细胞计算得来。
LSM方法非常简单和实用,因为它几乎可以添加任何类型的限制以解决问题(例如,非负性、平等性、单峰性等)。如前所述,参考光谱矩阵必须是事先已知的,因此必须在相同的仪器条件下对单染样品进行单独检测。该算法假设测量的光谱与各个组分光谱是线性相关。这要求参考光谱是线性无关且恒定的,但这个条件并不总是适用。例如,如果两个荧光探针发生荧光共振能量转移(FRET),或者根据细胞微环境改变它们的光谱,这种假设就不成立。
此外,要特别注意考虑背景。背景的最大来源通常是细胞的自发荧光,它通常被当成一个参考光谱,在LSM解析中通过多项式来建模。然而,在不同的细胞类型、不同的实验处理以及不同的激发波长下,自发荧光可能会发生变化,因此在LSM解析时,需要谨慎判断如何建立自发荧光模型。
5.2 主成分分析(PCA)
主成分分析(PCA, Principal Component Analysis)是一种无监督的解析技术,通过提取具有最大方差的组件并相应地减少数据的维数,进而来揭示数据的内部结构。简而言之,在执行PCA之后,可以使用一组新的不相关的参数或主成分来导航数据,这些参数或主成分可以让用户识别观察到的光谱。
在光谱流式中,主成分分析法可以用来寻找少数几个代表整个数据集的参考光谱。第一个光谱是对测量光谱贡献最大的;第二个贡献较少,依此类推。这种类型的统计分析是自动进行的,在没有任何已知光谱信息的情况下,用户可以确定每个测量的光谱中存在不同的荧光染料。
PCA是一种非常强大的方法,能够区分数据集中的不同组分(噪声、细胞亚群等),但通常需要对数据进行某种统计学上的预处理,以便更好地区分。这些预处理步骤包括平滑化、标准化和数据转换,而PCA结果主要取决于数据的预处理和变量的选择。此外,在LSM使用的非负性和其他典型限制,在其他解析方法中不能应用标准线性PCA,其结果可能在数学意义上是最优的,但缺乏实际意义,因此,不可能对差异分群进行多种类型的定量分析。基于这些原因,PCA和其他解析算法,经常被用于提升某种算法的性能(例如,PCA用于预分类,而基于LSM的算法用于定量)。
5.3 多元曲线分-交替最小二乘法(MCR‐ALS)
多元曲线分辨-交替最小二乘法(MCR-ALS, Multivariate Curve Resolution—Alternating Least Squares)是一种强大的因子分析技术,可与PCA或其他无监督算法结合使用,分析光谱图像数据。MCR-ALS已广泛应用于化学计量分析、显微成像、高光谱微阵列扫描和体内荧光成像。在光谱成像中,解析过程通常涉及到组分提取,来估计各个参考光谱和浓度分布(通常使用PCA或另一种无监督分析技术奇异值分解(SVD))。随后,MCR-ALS算法在数据集上运行,使用中间数据和所需的算法限制作为输入。这一步骤被认为是一个最优化过程,对参考光谱和乘数因子矩阵交替提取。
MCR相对于其他多元分析方法(最小二乘法、线性解析)的优点包括能够对未知光谱 (如干扰、背景和仪器伪影)进行建模,并在已知信息很少或没有的情况下发现各个组分光谱。必须指出的是,用这种方法得出的解析结果,非常依赖于参考光谱的初始值。
6应用
6.1 光谱相似度高的染料
利用高效的平顶激光束和高量子产率半导体检测器,该系统可以解析光谱高度重叠的染料。BV711和Qdot705 (~ 700nm)这两种染料在传统流式上是不能同时使用的,因为它们使用相同的检测器和滤光片。然而,每一种染料在三束激光下的全部发射光谱特征是独特的,使用光谱流式可以很容易地从其他染料中区分出来。
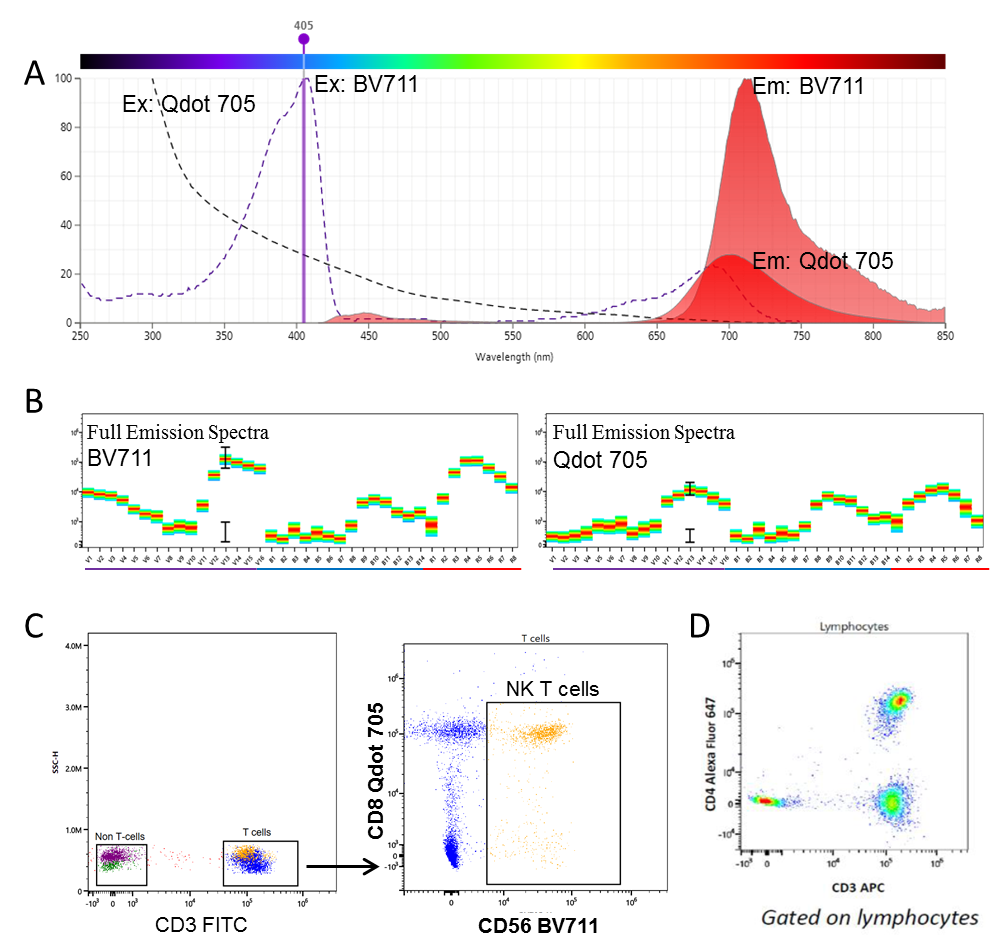
图8. (A) Qdot 705和BV711这两种染料的发射光谱高度重叠,在传统的流式上不能同时使用。(B) 然而,这两种染料有不同的特征,他们可以被用在全光谱流式中。(C)这些染料可同时用于识别感兴趣的细胞群,如T细胞共表达 CD8和CD56。(D)类似的,APC和Alexa Fluor 647也可同时使用。
Full-Spectrum Technology Deepens the Reach of Flow Cytometry. Ming Yan And Gil Reinin, Cytek Biosciences.
6.2 自发荧光解析
自发荧光存在于所有的细胞中,并且自发荧光的强度和模式会随着细胞类型、大小和细胞状况等因素而变化。此外,细胞制备试剂,如固定剂和破膜剂,也可以改变自身荧光模式。
在传统流式中,自发荧光通过荧光染料的补偿矩阵进行“补偿”。由于自发荧光光谱较宽,且与许多荧光染料重叠,传统的流式很难将自发荧光信号与其他信号区分开来。因此,强自发荧光群体在散点图中呈现对角线模式。在传统的流式中,强自发荧光样品和染色样品中都可以看到这种对角线模式,造成假阳性结果。
在光谱流式中,荧光染料的参考光谱被用来进行光谱解析计算,以确定荧光色的强度。也可以使用未染色细胞的自发荧光作为参考光谱。光谱解析可以将自发荧光识别为单独的信号,并将其定义为单独的颜色,因此它可以提供更准确的结果。

图9. 用荧光染料和自发荧光光谱进行光谱解析计算。未使用或使用自发荧光参考光谱显示了PerCP-Cy5.5 (CD4)和 BV510 (CD8)的密度图。在没有使用自发荧光参考光谱的图中,观察到一些对角线群体。在未染色的样品中观察到同样的模式,表明它们是来细胞自发荧光的假阳性产物。当将自发荧光参考光谱加入到光谱解析过程中时,这些伪影被成功去除。
Method and Theory of the Autofluorescence Unmixing in SP6800 Spectral Cell Analyzer. Nao Nitta, Ph.D., Greg Veltri, Ph.D., Mark Dessing. Sony Corporation
7 参考文献**
[1] Nolan, J. P. and D. Condello (2013). “Spectral flow cytometry.” Curr Protoc Cytom Chapter 1: Unit1 27.
[2] Spectral Flow Cytometry - the real story. Purdue Univerty.
[3] Robinson, J. P. (2019). “Spectral flow cytometry-Quo vadimus?” Cytometry A 95(8): 823-824.
[4] Futamura, K., et al. (2015). “Novel full-spectral flow cytometry with multiple spectrally-adjacent fluorescent proteins and fluorochromes and visualization of in vivo cellular movement.” Cytometry A 87(9): 830-842.
[5] Ferrer-Font, L., et al. (2020). “Panel Design and Optimization for High-Dimensional Immunophenotyping Assays Using Spectral Flow Cytometry.” Curr Protoc Cytom 92(1): e70.
[6] Nao Nitta, et al. (2015). Spectral Unmixing with Sony Spectral Analyzers. Sony Corporation.
[7] Masashi Sekino, et al. Probabilistic Spectrum Compensation for Flow Cytometry. Sony Corporation.
[8] Ming Yan and Gil Reinin. Full-Spectrum Technology Deepens the Reach of Flow Cytometry. Cytek Biosciences.
[9] Nao Nitta, et al. Method and Theory of the Autofluorescence Unmixing in SP6800 Spectral Cell Analyzer. Sony Corporation.

