脑小胶质细胞和星形胶质细胞在脑损伤和神经炎症中起关键作用。 这些神经胶质细胞的激活以及中枢神经系统中的白细胞浸润有助于调节许多神经病理学中的神经元存活。 胶质细胞系/原代星形胶质细胞和原代小胶质细胞培养等体外模型已被广泛用于研究特定脑细胞的作用,有助于鉴定涉及神经免疫的因素。 然而,这些模型无法模仿大脑中细胞相互作用的复杂性。 神经变性和脑修复的研究最终需要依靠体内方法,但在这些方法中,由于难以分离脑细胞,所以检测单细胞群体的表型会更具挑战性。
通常,大脑免疫细胞的分离方法是基于单独的机械解离或结合酶消化的机械解离。从大脑中分离出的小胶质细胞和星形胶质细胞可以混合培养,并通过胰蛋白酶消化和摇动进一步分离。但是,适用于培养细胞的分离方案通常对脑细胞的解离不是那么有效,尤其是成年小鼠的脑组织消化特别具有挑战性。已有的研究一般用许多酶解离方法,目的是在保持完整性的同时从脑中以高产率提取细胞,诸如木瓜蛋白酶、胶原酶II和分散酶II之类的酶是最推荐的。不幸的是,现有文献没有在细胞产量、纯度或完整性上面做完整的优化。
Calvo, Belén在IBRO Rep. 2020 Jun对解离方法和基于Percoll的分离进行比较分析: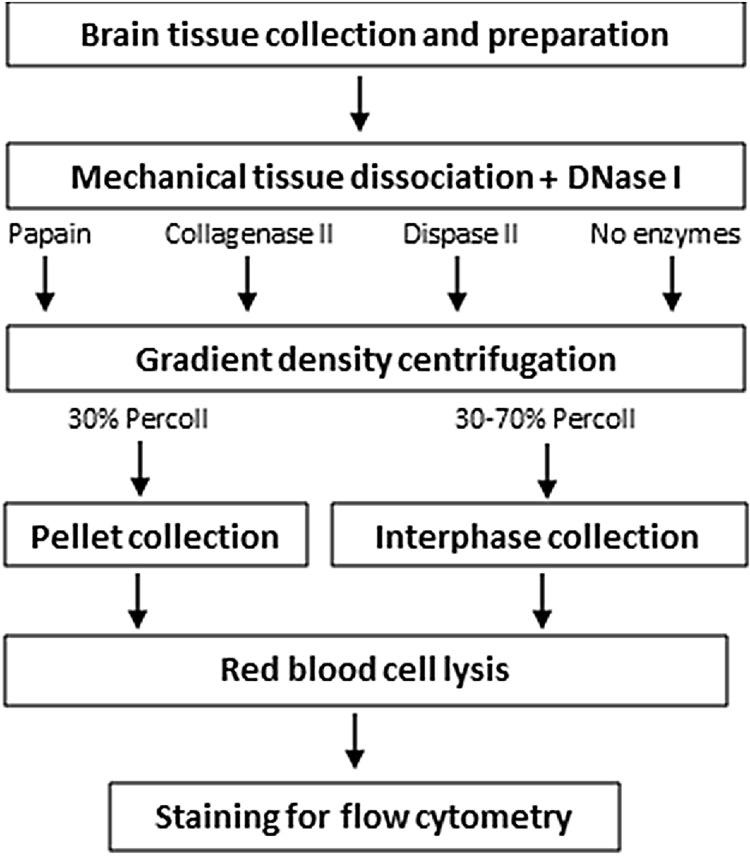
对上述步骤做一些细节描述:
取出小鼠大脑,去掉小脑和嗅球后,将其放入冷的Hanks平衡盐溶液中(不含氯化钙或氯化镁)。仔细分离脑膜、血管和脉络丛;消化前用解剖刀切碎组织。
将切碎的脑组织以5 ml的总体积放置在MACS C管(Miltenyi Biotec 130-093-237)中,并以6 rpm的速度机械解离处理30分钟。之后,分以下几组:
(1)在Earle’s平衡盐溶液中进行非酶解离。
(2)木瓜蛋白酶(100 U,Worthington LK003178,HBSS配制)酶解。
(3)胶原酶II(600 U,Millipore 234155,HBSS配制,含90 mM Ca2+)酶解 。
(4)Dispase II(6 U,Sigma-Aldrich D4963,EBSS配制)酶解 。
(5)木瓜蛋白酶和Dispase II组合酶解。
(6)胶原酶II和Dispase II组合酶解。
所有溶液均添加DNAse I(100 U,Sigma-aldrich DN25)。使用前,将木瓜蛋白酶在37°C和5%CO2下活化30分钟。为停止所有酶的消化,将样品用冷HBSS稀释并置于冰上,然后使用5 ml移液器将溶液进一步打匀10次,并通过70μm细胞过滤器过滤,将得到的单细胞悬液在RT下以300g离心10分钟。
接着,使用Percoll™(GE Healthcare 17-0891-01)梯度离心去除髓磷脂并富集活胶质细胞的匀浆。制备等渗Percoll(SIP)的储存液(9份Percoll,1份10x HBSS)。将细胞沉淀重悬于30%(3 ml SIP加到7 ml 1X HBSS重悬的细胞悬液上方)或30–70%(将3ml用1x HBSS稀释的70%SIP溶液放入14ml试管中,然后用10 ml含有细胞悬液的30%SIP覆盖)SIP。 对于两种类型的Percoll离心,均需加入1X HBSS进行洗涤,以300 g离心10分钟,然后重悬于10 ml 1X红细胞裂解缓冲液中,最后将细胞沉淀重悬于50μl封闭缓冲液中,该封闭缓冲液由1X PBS、0.5%牛血清白蛋白(BSA)和2 mM EDTA配制而成。
流式细胞仪染色在4°C下进行。 为了封闭小胶质细胞或巨噬细胞中的表面抗原,将0.5μl小鼠FcR封闭试剂(1:100稀释,Miltenyi Biotec 130-059-901)添加到含有细胞悬液的封闭缓冲液中,并孵育10分钟。 随后,加入识别小鼠CD45、CD11b、ACSA-1、ACSA-2等荧光素抗体的混合物(1:11至1:20稀释,详见下表)。
为了确定细胞死活,添加DAPI并孵育10分钟。 1μg/ mlDAPI浓度比较适合区分活细胞和死细胞(Gordon et al。,2003)。 样本用1 ml封闭缓冲液洗涤,并在300g下离心5分钟。 最后,将细胞沉淀重悬于500μlPBS中,并立即上机。
流式设门步骤如下图,值得参考,将星形胶质细胞、活化小胶质细胞、静息小胶质细胞、淋巴细胞均清晰的区分开: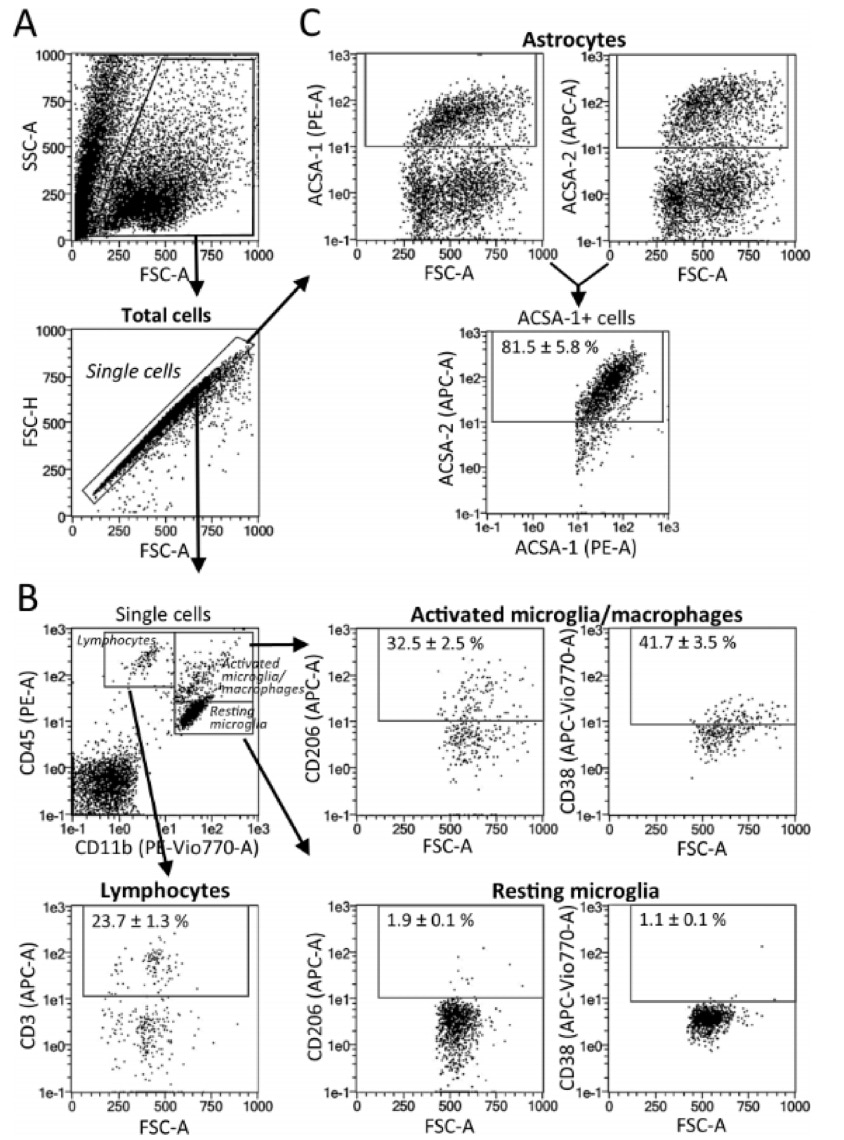
实验结果如下:
1、在没有酶促孵育的情况下,使用机械解离可以更好地得到星形胶质细胞,而酶通常会损害星形胶质细胞。但是,与酶处理相比,新生小鼠和成年小鼠大脑的非酶消化通常导致总细胞、小胶质细胞和淋巴细胞的得率较低。
2、组织消化后去除髓磷脂和细胞碎片不仅对于流式细胞仪至关重要,对于其他下游应用(包括基因和蛋白质表达的测量)也至关重要。该研究采用两种密度梯度离心:30%和30–70%,发现使用30%Percoll,总细胞回收率提高了三倍以上。像这样的单一梯度主要旨在有效去除髓磷脂和碎片。与多密度梯度相比,它们的设置时间更少,并且避免了从层间相移液的困难。此外,在30%Percoll中离心的细胞中通常具有较高的活力。
3、关于酶消化,该研究集中于木瓜蛋白酶、胶原酶II和Dispase II。 尽管一些研究使用胰蛋白酶消化大脑(Bronstein等,2013; Saura等,2003; Schildge等,2013),但有证据表明该酶可以激活神经胶质细胞并损害其活力(He等, 2019年; Singh等,2014年)。 因此,胰蛋白酶与其他酶(如透明质酸酶或Accutase)均被排除在外。
4、根据研究中的数据,木瓜蛋白酶与Dispase II结合可以有效地从新生小鼠中提取总神经细胞(每个大脑5.6×10E6),或从成年小鼠大脑中提取静息小胶质细胞(占总细胞的21%)。另外,木瓜蛋白酶通常对新生小鼠细胞的危害要小于其他酶。然而,木瓜蛋白酶对成年小鼠星形胶质细胞影响特别大。
5、关于中性蛋白酶Dispase II,当单独使用时,表现温和,其解离值通常接近非酶消化。 但是,将Dispase II与木瓜蛋白酶联合使用时,观察到从新生小鼠提取的总细胞数量显著增加,并且从成年小鼠中回收的静息小胶质细胞和淋巴细胞数量得到改善(分别为32%和52%) 。 但是,添加Dispase II通常会降低提取的细胞活力。 即使如此,仍认为木瓜蛋白酶与Dispase II组合是从成年小鼠大脑获得静息小胶质细胞的最佳选择。
6、尽管胶原酶II 通常用于从中枢神经系统中分离免疫细胞,但在此实验中,相对于其他方法,总神经细胞的回收率较差。
这样,整篇文章下来,既完整的教了大家获取小鼠大脑免疫细胞的最佳方法,而且给出了检测小鼠大脑星形胶质细胞、活化小胶质细胞、静息小胶质细胞、淋巴细胞的方案和设门步骤。非常值得大家参考。
参考文献:Calvo, Belén et al. “Dissociation of neonatal and adult mice brain for simultaneous analysis of microglia, astrocytes and infiltrating lymphocytes by flow cytometry.” IBRO reports vol. 8 36-47. 13 Jan. 2020, doi:10.1016/j.ibror.2019.12.004

