原发性免疫缺陷(PID)是由单基因突变引起的,这些突变破坏了免疫细胞的发育、成熟、分化和/或功能。因此,具有PID的个体极易受到多种病原体的感染。
要找出引起PID患者临床表现的根本原因,第一步就是确定可能存在的任何发育或功能性淋巴细胞缺陷。这一点很重要,因为有不少实例,尽管确定了遗传原因,但尚不清楚这些基因缺陷导致疾病发病的机制。
因此,通过基于流式细胞仪对PID患者外周血中免疫细胞群的分析,为不同的PID人群建立“免疫细胞指纹”,将有助于诊断这些患者,并揭示潜在的细胞缺陷。
举例来说,STAT3杂合子显性突变伴常染色体显性形式高IgE综合征(AD-HIES)的患者,表现为复发性机会性念珠菌(真菌)和葡萄球菌(细菌)感染以及抗体反应受损。但是,这些患者为什么会这样呢?通过流式对免疫细胞组成的分析,发现这类患者有独特的淋巴细胞组成特征:MAIT和NKT减少,但γδT细胞正常,CD4+CCR6+ Th17和CD4+CXCR5+循环滤泡辅助T(cTfh)细胞减少,CD20+CD27+记忆B细胞减少。从这些特征中,很明显就可以看出,正是由于Th17细胞的减少导致患者真菌感染的机会性增加,而记忆B细胞和Tfh细胞的减少解释了这些患者的抗体产生障碍。
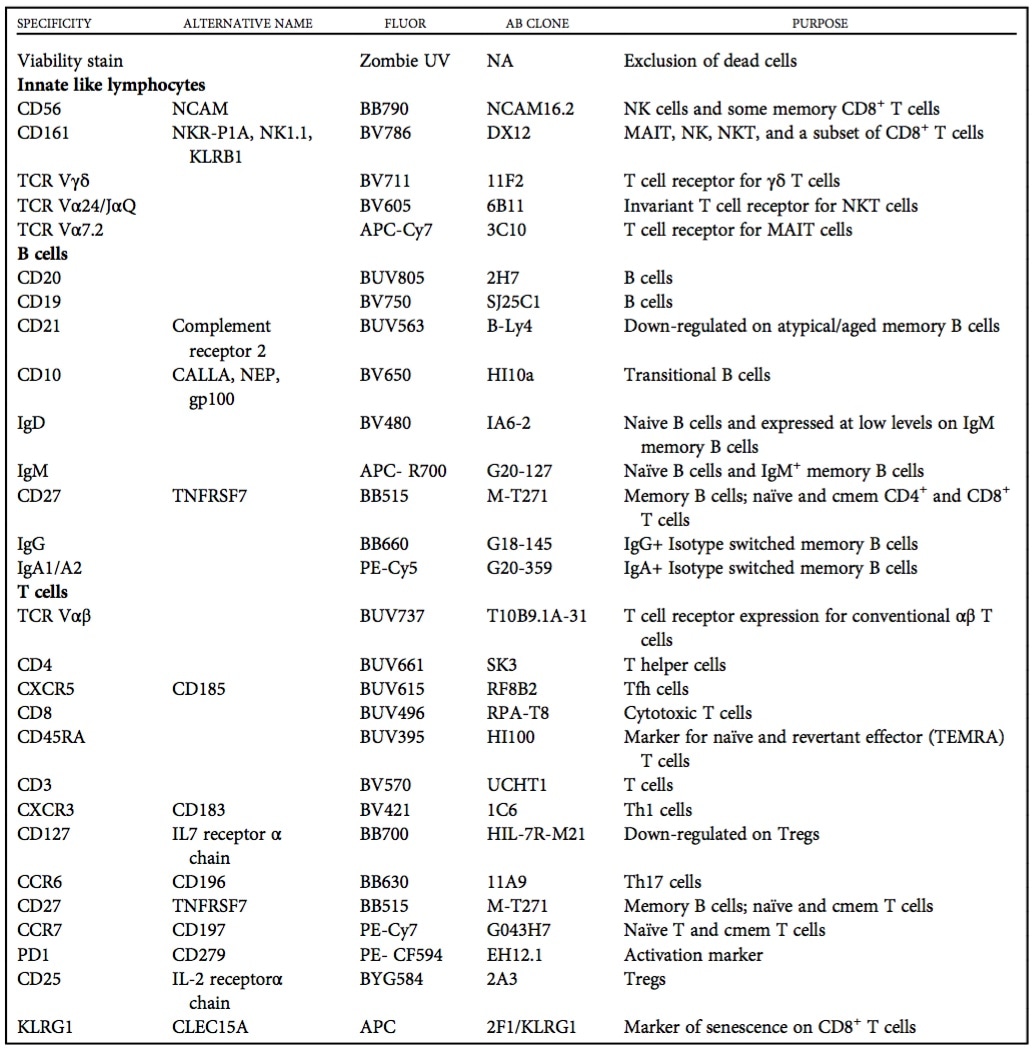
澳大利亚的Kathryn Payne等人在4月16日的Cytometry A.杂志上发布了她们优化过的28色方案,可有效筛查PID患者。 该方案着重于分析外周血中B、CD4和CD8 + T细胞和NK细胞以及NKT、γδ和MAIT细胞的主要亚群,不仅可以确定主要淋巴细胞亚群的成熟状态,还可以对其进行量化,详见下表:
方案的抗体组成
设门步骤
首先是去除粘连体、圈淋巴细胞、去死细胞(A图),接着通过CD3/CD20分出T细胞和B细胞,通过CD3/CD56分出NK细胞(B图),之后在CD3+T细胞中,依次分出CD4+T、CD8+T、MAIT、NKT、γδT、αβT,接着对CD4+T进一步分出Treg和非Treg,分出初始、中央记忆、效应三部分(这里效应记忆似乎没分),并利用PD-1评估其耗竭情况,同样CD8+T也分为初始、中央记忆、效应、效应记忆,并利用KLRG1评估其效应能力。最后,则评估了非Treg部分的组成,分为Tfh、初始、记忆三部分,并评估三部分的Th1、Th2、Th17、Th1/Th17组成情况。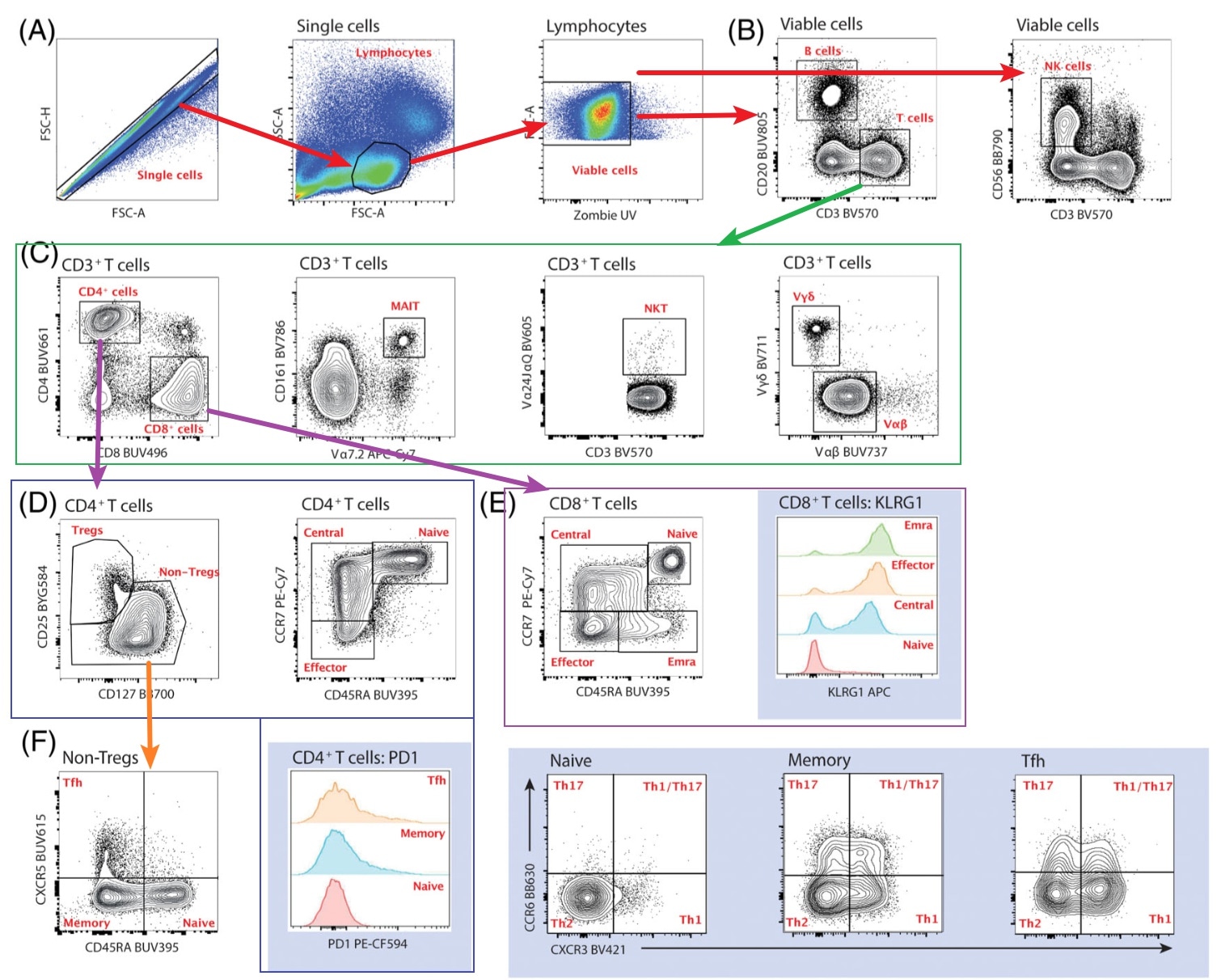
接下来是B细胞,B细胞根据CD21的表达,分出小群的CD19high CD21low的B细胞,这类B细胞可能是非典型或衰老的记忆B细胞,剩余的CD19+CD21+B细胞,则是我们后续要细分的,根据CD10和CD27,分出过渡B、纯真B、记忆B三部分,并对这三部分进行IgD、IgM、IgA、IgG的表达评估。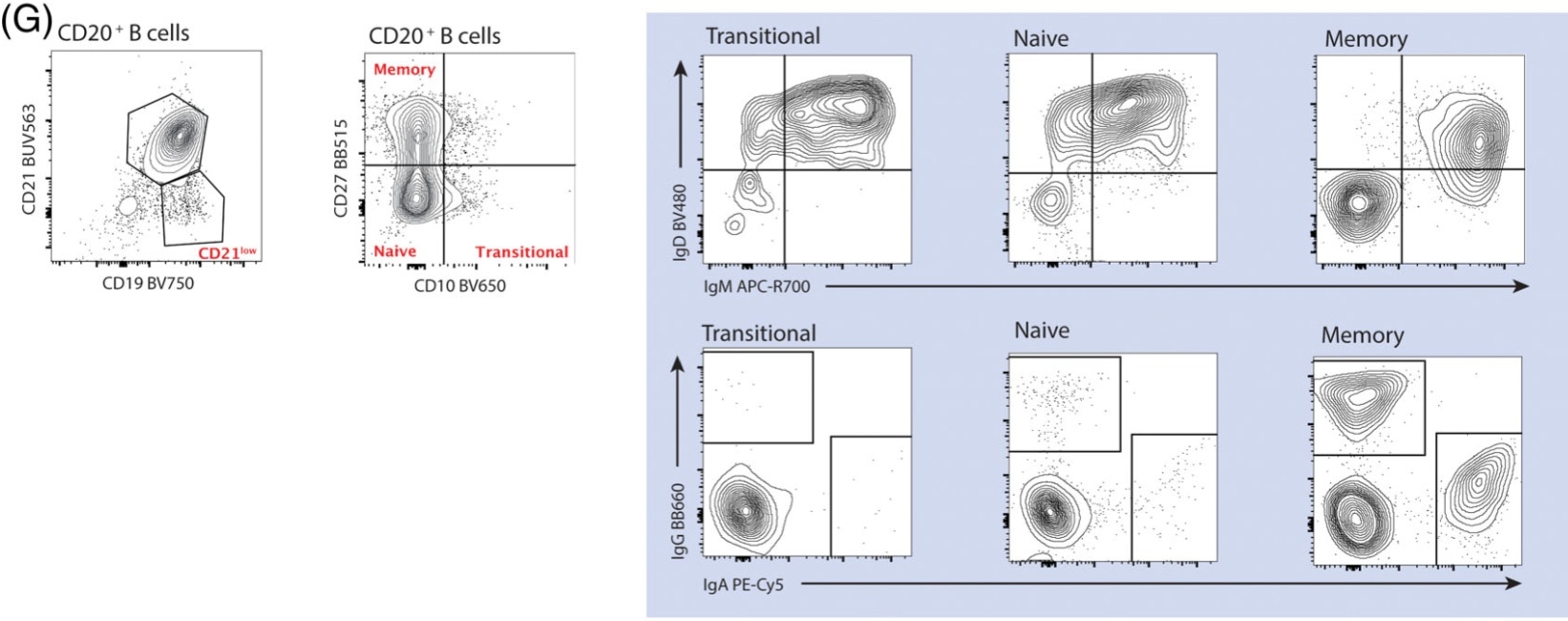
这个方案,相对来说思路还是比较清晰的。如果28色做不了,可以想办法拆分成多管,按此思路走。
参考文献:Payne K, Li W, Salomon R, Ma CS. OMIP-063: 28-Color Flow Cytometry Panel for Broad Human Immunophenotyping [published online ahead of print, 2020 Apr 16]. Cytometry A. 2020;10.1002/cyto.a.24018. doi:10.1002/cyto.a.24018

