从生物体液中分离尽可能纯的细胞外囊泡(EV)至关重要,因为可溶性蛋白和脂蛋白的共分离可能会阻碍对实验结果的解释。例如基因组、蛋白质组学和脂质组学研究要求EV尽可能纯净,以确保所测量的是与EV相关的成分,而不是干扰杂质。无论要从哪种类型的生物样本中分离以及使用哪种分离方法,了解EV的特性,例如粒径分布、颗粒浓度、纯度和表型,对于确保下游分析的灵敏度和准确性十分重要。与血清相比,血浆通常是首选的EV来源,因为在制备血清时血凝块形成过程中血小板会释放出更多的EV。
厦门大学的颜晓梅教授课题组,利用她们自己制造的纳米流式细胞仪(nFCM),评估了从血浆(最难分出EV的体液之一)中分离出EV的质量和效率。她们共验证了五种广泛使用的商业分离试剂盒的性能,并将其与传统的差异超速离心(UC)进行了比较。与通过UC制备的EV相比,通过试剂盒从无血小板血浆(PFP)制备的EV颗粒浓度高出2至4个数量级,但纯度却低得多。
同时,在下图nFCM检测结果可以明显看出,用试剂盒制备的EV其粒度分布曲线与PFP的粒度分布图非常相似,说明存在较多的血浆蛋白和脂蛋白的污染,而通过UC制备的EV在相对较大的粒度下显示出较宽的粒度分布。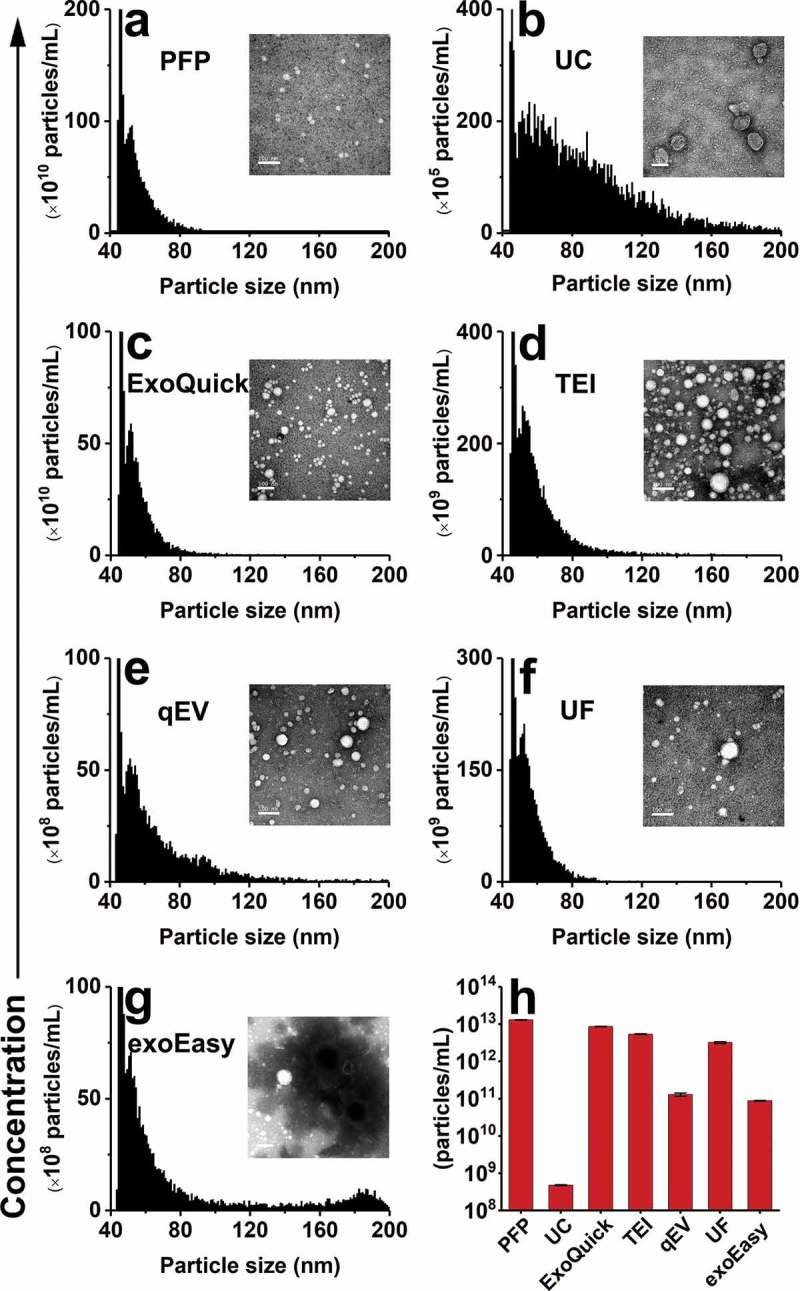
文中提到确认EV纯度的方法,也属于文章的一大亮点。既往较多文献提出了颗粒计数(通过NTA测量)与蛋白质含量(通过BCA分析获得)的比率,并将其用作评估EV纯度的标准。但是,NTA既无法检测到小于70 nm的囊泡,也无法区分囊泡和大小相似的脂蛋白或蛋白质聚集体,这很容易导致EV计数不准确。同时,BCA分析虽然可以测量EV的总蛋白浓度,但其中可能包括大量的脂蛋白和其他非囊泡蛋白。通过对通过UC和SEC从血浆中分离出的EV的回收率、纯度和功能潜力进行系统研究,发现颗粒/蛋白质比不是血浆EV纯度的准确测量方法。由于双层脂质膜是EV的最显著特征,作者就提出了一种简单而便捷的方法,就是通过使用nFCM分别检测用1%Triton X-100裂解EV膜之前和之后的颗粒计数,因为只有EV被破坏而信号消失,所以准确量化EV的纯度,这种单粒子方法基于光散射检测,因此不需要荧光标记。如下图b和c,EV处理前后,信号数从5062减少到1124,减少的3938可认为是EV,那么纯度就是3938/5062=77.80%;下图的d和e是极低密度脂蛋白,不具有双层脂质膜,因此不受Triton影响,颗粒数反而增多,故纯度成负值。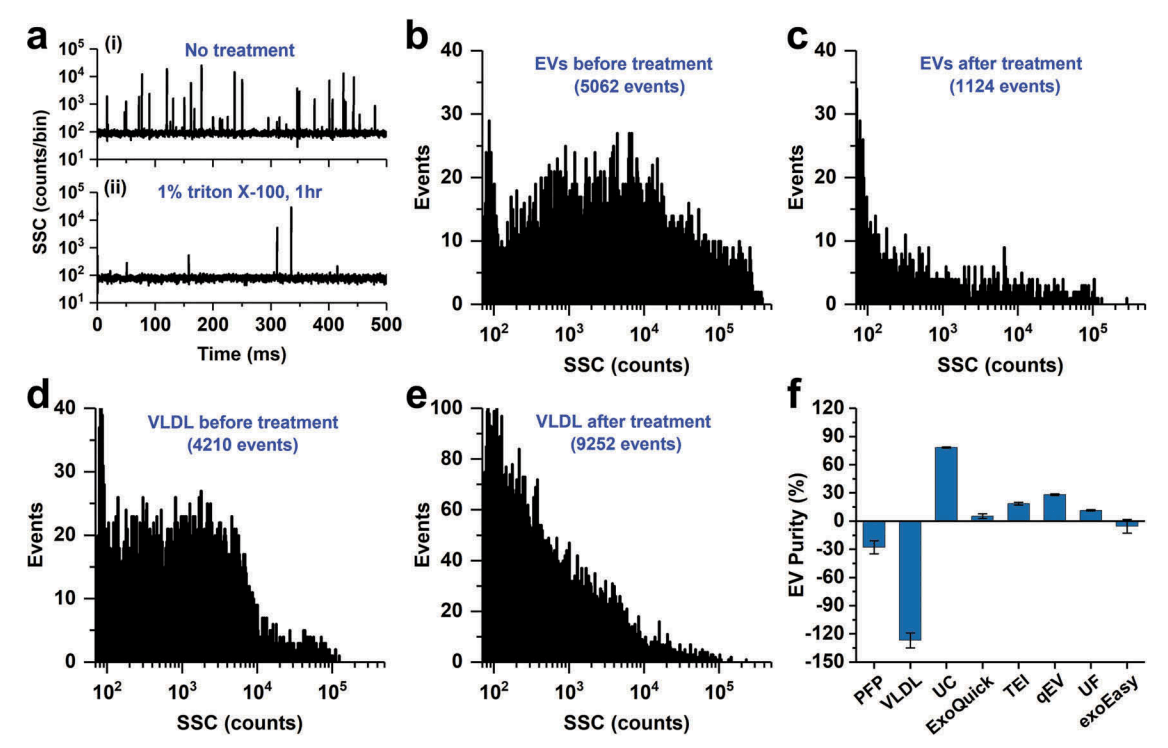
综上,作者认为UC(超速离心)仍然是目前分离EV最好的方法,并提出了建议:为了将EV从血液中有效分离出来,并且避免血浆蛋白和脂蛋白颗粒污染,建议可以采用多种分离方法的组合,例如UC联合density cushion和SEC,或者是UC联合梯度密度UC。
文献源:Tian Y, Gong M, Hu Y, et al. Quality and efficiency assessment of six extracellular vesicle isolation methods by nano-flow cytometry. J Extracell Vesicles. 2019;9(1):1697028. Published 2019 Nov 29. doi:10.1080/20013078.2019.1697028(https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6896440/pdf/ZJEV_9_1697028.pdf)

