造血干细胞(HSC)是骨髓中的稀有细胞,但是在生成血细胞方面是至关重要的。造血干细胞通过产生祖细胞来介导这一过程,而祖细胞又通过几轮细胞分裂和精心安排的分化步骤产生最终分化的成熟血细胞谱系。
HSC通过厌氧糖酵解产生能量,相反,它们分化出来的定向祖细胞代谢较活跃,并且代谢方式从糖酵解转换为线粒体代谢。这种独特的代谢状态可以保护HSC免受由线粒体产生的活性氧(ROS)造成的细胞损伤,从而维持其长期的体内功能。
HSC代谢状态的直接测量很具有挑战性,因为数量实在太少了,平时常用于测量小动物代谢活性的SeaHorse根本没法定位HSC。Girotra M等人在2019年12月26日Jove杂志上描述了一种基于流式细胞仪的测定方法,结合HSC分选、培养以及HSC标记,采用四甲基若丹明甲酯(TMRM)荧光来稳定测量线粒体膜电位(ΔΨm),用绿色荧光线粒体染色剂(Mitotracker Green)来测定线粒体质量。
既往认为低ΔΨm是高纯度HSCs9的真正功能标记,而能够降低ΔΨm的代谢调节剂可增强HSCs功能,促进造血功能,因此,作者同时还利用了维生素B3类似物烟酰胺核糖苷(NR)时降低HSC的ΔΨm。
此外,因为近年来,使用自体肿瘤浸润淋巴细胞(TIL)进行过继细胞疗法(ACT)已成为某些类型预后极差的晚期癌症(例如转移性黑素瘤)的最有效方法,然而,具有足够的抗肿瘤活性的TIL难以产生,TIL在离体扩增过程中经历的广泛增殖和刺激会导致T细胞功能耗竭,从而大大削弱T细胞的抗肿瘤反应。而TIL的抗肿瘤能力与其代谢密切相关,已发现通过抑制PI3K/Akt途径来调节代谢的方法相当有效,因此,作者比较了来自外周血单核细胞(PBMC)和患者来源的TIL的T细胞的ΔΨm,并表明与终末分化的TIL相比,PBMC的T细胞具有较低的ΔΨm和线粒体质量。
整个实验流程大致分为以下三步
- 造血干细胞提取
下图A是分选造血干细胞的设门图,B是分选出来之后,第2步体外扩增的96孔板位置分配图
- 造血干细胞扩增,2x basal medium中加入stem cell factor (200 ng/mL)、FLT3 ligand (4 ng/mL) 和青霉素-链霉素(1%),一组正常培养,一组加入NR。
- 造血干细胞线粒体膜电位和线粒体质量检测。每孔加入2ul TMRM (20 µM) 和2ul Mitotracker green (10 µM)。
具体步骤很多,而且很详细,请参见附件PDF原文。
从下图的结果看,很明显,添加NR之后,HSC的线粒体膜电位发生降低,TMRM low的细胞比例增高,而线粒体质量虽然有所降低,但无显著差异。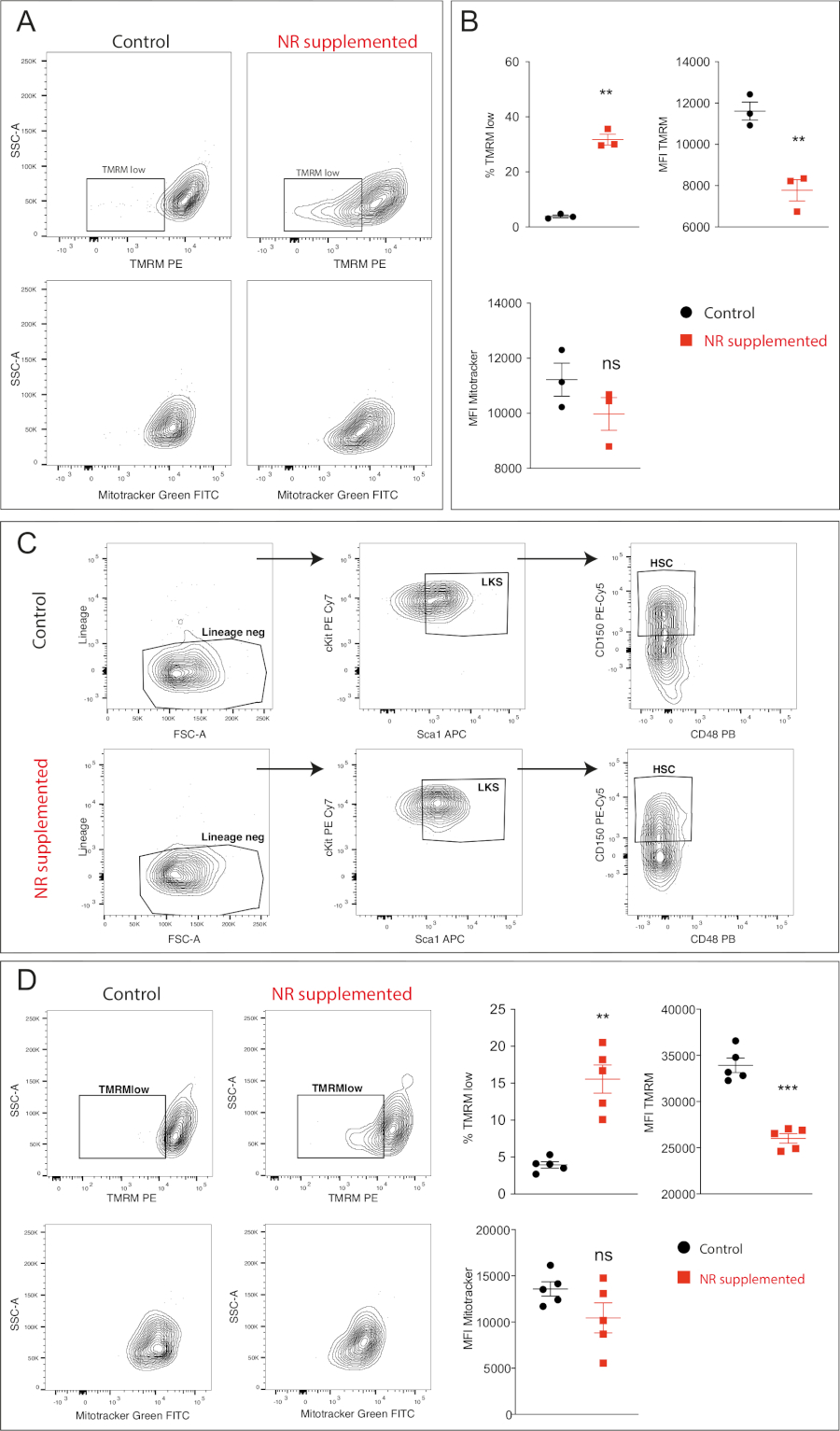
在PBMC或TIL中分选出的CD4+T和CD8+T中,可发现TIL细胞CD4+T和CD8+T线粒体膜电位和质量均高于PBMC,说明TIL代谢活跃,功能耗竭现象明显。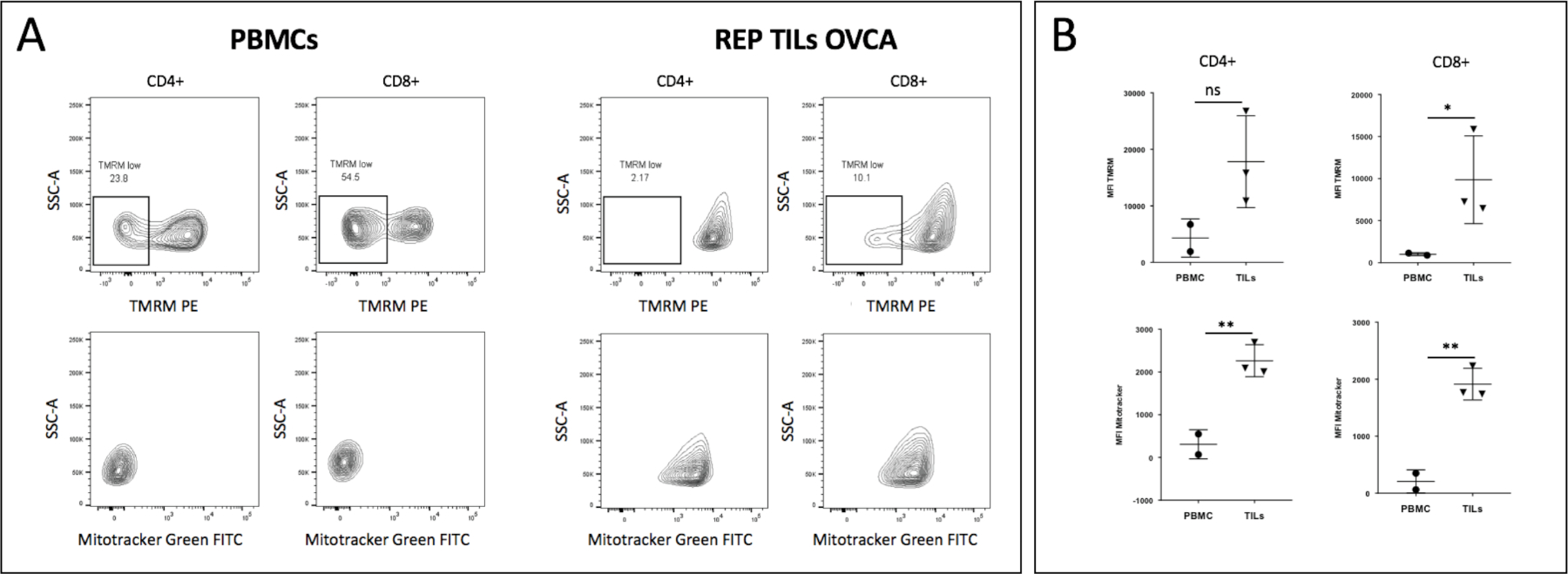
可见线粒体膜电位和线粒体质量,在科研中有助于细胞代谢活性的确认,从而了解细胞功能状态,但最后需要补充一句,当前阶段,切勿直接将线粒体相关检测直接用在临床检测实践的淋巴亚群功能检测上,那种做法很危险,往往可能因为标本状态而受影响。流式的临床应用,需要谨慎、科学地去完善,而不是不惜手段地疯狂扩张。
参考文献:Girotra M, Thierry AC, Harari A, Coukos G, Naveiras O, Vannini N. Measurement of Mitochondrial Mass and Membrane Potential in Hematopoietic Stem Cells and T-cells by Flow Cytometry. J Vis Exp. 2019;(154):10.3791/60475. Published 2019 Dec 26. doi:10.3791/60475

