差异分析的套路都是差不多的,大部分设计思想都是继承limma这个包,DESeq2也不例外。
DESeq2是DESeq包的更新版本,看样子应该不会有DESeq3了,哈哈,它的设计思想就是针对count类型的数据。
可以是任意features的count数据,比如对各个基因的count,或者外显子,或者CHIP-seq的一些feature,都可以用来做差异分析。
使用这个包也是需要三个数据:
- 表达矩阵
- 分组矩阵
- 差异比较矩阵
总结起来三个步骤,我下面会一一讲解
- 重点就是构造一个dds的对象,
- 然后直接用DESeq函数进行normalization处理即可,
- 处理之后用results函数来提取差异比较结果。
读取自己的数据
一般我们会自己读取表达矩阵和分组信息,下面是一个例子:
options(warn=-1)suppressMessages(library(DESeq2))suppressMessages(library(limma))suppressMessages(library(pasilla))data(pasillaGenes)exprSet=counts(pasillaGenes)head(exprSet) ##表达矩阵如下## treated1fb treated2fb treated3fb untreated1fb untreated2fb## FBgn0000003 0 0 1 0 0## FBgn0000008 78 46 43 47 89## FBgn0000014 2 0 0 0 0## FBgn0000015 1 0 1 0 1## FBgn0000017 3187 1672 1859 2445 4615## FBgn0000018 369 150 176 288 383## untreated3fb untreated4fb## FBgn0000003 0 0## FBgn0000008 53 27## FBgn0000014 1 0## FBgn0000015 1 2## FBgn0000017 2063 1711## FBgn0000018 135 174(group_list=pasillaGenes$condition)## [1] treated treated treated untreated untreated untreated untreated## Levels: treated untreated##这是分组信息,7个样本,3个处理的,4个未处理的对照!
第一步:构建dds对象
那么根据这两个数据就可以构造dds的对象了
colData <- data.frame(row.names=colnames(exprSet),group_list=group_list)## 这是一个复杂的方法构造这个对象!dds <- DESeqDataSetFromMatrix(countData = exprSet,colData = colData,design = ~ group_list)## design 其实也是一个对象,还可以通过design(dds)来继续修改分组信息,但是一般没有必要。dds## class: DESeqDataSet## dim: 14470 7## exptData(0):## assays(1): counts## rownames(14470): FBgn0000003 FBgn0000008 ... FBgn0261574## FBgn0261575## rowData metadata column names(0):## colnames(7): treated1fb treated2fb ... untreated3fb untreated4fb## colData names(1): group_list
可以看到我们构造的dds对象有7个样本,共14470features
从基因名可以看出,是果蝇的测序数据
我们也可以直接从expressionSet这个对象构建dds对象!
library(airway)data(airway)suppressMessages(library(DESeq2))dds <- DESeqDataSet(airway, design = ~ cell+ dex)design(dds) <- ~ dex## 构造好的对象还可以更改分组信息
第二步:做normalization
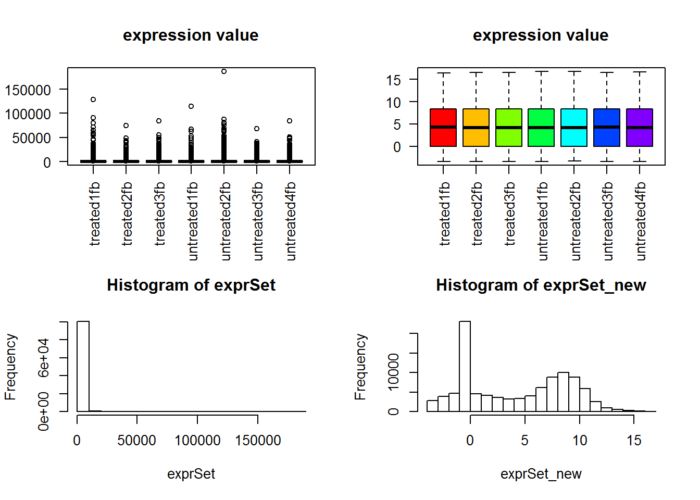
suppressMessages(dds2 <- DESeq(dds))##直接用DESeq函数即可## 下面的代码如果你不感兴趣不需要运行,免得误导你## 就是看看normalization前面的数据分布差异rld <- rlogTransformation(dds2) ## 得到经过DESeq2软件normlization的表达矩阵!exprSet_new=assay(rld)par(cex = 0.7)n.sample=ncol(exprSet)if(n.sample>40) par(cex = 0.5)cols <- rainbow(n.sample*1.2)par(mfrow=c(2,2))boxplot(exprSet, col = cols,main="expression value",las=2)boxplot(exprSet_new, col = cols,main="expression value",las=2)hist(exprSet)hist(exprSet_new)
第三步:提取差异分析结果
resultsNames(dds2)## [1] "Intercept" "group_listtreated" "group_listuntreated"## 其实如果只分成了两组,并没有必要指定这个比较矩阵!res <- results(dds2, contrast=c("group_list","treated","untreated"))## 提取你想要的差异分析结果,我们这里是trt组对untrt组进行比较resOrdered <- res[order(res$padj),]resOrdered=as.data.frame(resOrdered)head(resOrdered)## baseMean log2FoldChange lfcSE stat pvalue## FBgn0039155 453.2753 -4.281830 0.1919977 -22.30146 3.576174e-110## FBgn0029167 2165.0445 -2.182745 0.1080670 -20.19807 1.017931e-90## FBgn0035085 366.8279 -2.436860 0.1505280 -16.18875 6.054219e-59## FBgn0029896 257.9027 -2.511257 0.1823764 -13.76964 3.881667e-43## FBgn0034736 118.4074 -3.166392 0.2375506 -13.32933 1.562878e-40## FBgn0040091 610.6035 -1.526400 0.1278555 -11.93848 7.457520e-33## padj## FBgn0039155 2.764025e-106## FBgn0029167 3.933795e-87## FBgn0035085 1.559769e-55## FBgn0029896 7.500351e-40## FBgn0034736 2.415897e-37## FBgn0040091 9.606528e-30
差异分析结果很容易看懂啦!
原文来自:www.bio-info-trainee.com
- 版权声明 本文源自 生信菜鸟团, ybzhao 整理
- 转载请务必保留本文链接:https://www.plob.org/article/9971.html