本文翻译自Janeway’s Immunobiology第四章“Antigen Recognition by B-cell and T-cell Receptors”。
固有免疫是人体对抗感染的第一道防线,但是固有免疫仅能低于具有固定分子特征的病原体,或者介导干扰素或者其他非特异性的防御功能。为了更有效地对抗个体遭遇的广范围的病原体,适应性免疫系统中的淋巴细胞能够识别来自细菌、病毒和其他致病微生物的多种多样的抗原(antigen)。抗原是指能够被淋巴细胞的识别蛋白特异性识别的分子或者分子的一部分(An antigen is any molecule or part of a molecule that is specifically recognized by the highly specialized recognition proteins of lymphocytes)。B细胞的识别蛋白属于免疫球蛋白(immunoglobins/Igs)。B细胞分泌的免疫球蛋白能够特异性识别多种抗原,每个B细胞都能分泌的免疫球蛋白都是单特异的,仅能与单一种类的抗原结合。这些免疫球蛋白以与细胞膜结合的形式作为受体识别抗原,称为B细胞受体(B cell receptor/BCR)。识别同一种抗原的免疫球蛋白还存在分泌形式(secreted form),即为由终末分化的B细胞分泌。这种B细胞称为浆细胞/浆母细胞(plasma cells/plasmablasts)。这些分泌型抗体会结合到胞外的病原体或者病原体分泌的有毒产物上(toxic products)。
抗体是最先发现的参与到特异性免疫识别中的蛋白质,并且得到了很详尽的研究和理解。抗体分子有两种不同的功能:一是结合到病原体或者病原产物上,另一是募集(recruit)其他的细胞和分子来摧毁被抗体结合的病原体。例如,抗体与病毒结合可以中和(neutralize)病毒并且标记病毒以引发巨噬细胞和补体系统杀伤病毒(destruction)。抗体的这两种功能依赖于抗体分子上不同的两种结构,一种结构用于结合抗原,另一种则参与到病毒的杀伤过程(elimination mechanism)中。不同抗体分子之间的抗原结合区差异很大,称为可变区(variable region)或V区(V region)。抗体分子的可变性使得每个抗体都可以结合不同的抗原分子,因此个体全部抗体可变区的识别范围几乎覆盖了所有抗原结构。另一个区域即参与抗体杀伤效应功能的区域则和V区不同,称为恒定区(constant region)或C区(C region)。恒定区主要有五种形式,被称为同型体(isotype)。每个isotype能够特殊地参与到不同的效应机制中。与细胞膜结合的B细胞受体不具有这些效应功能,因为B细胞的C区是嵌入到细胞膜中的。B细胞受体的功能是通过V区识别并结合抗原分子并传送(transmitting)激活B细胞的信号,使B细胞扩增(clonal expansion)并产生抗体。为此目的,B细胞受体和许多胞内信号蛋白相互关联。
T细胞的抗原识别分子(antigen-recognition molecules)主要都是膜结合蛋白,这些膜结合蛋白与胞内信号相关联,仅只能够激活T细胞信号,称为T细胞受体(TCR)。TCR的蛋白结构和多样性产生的机制都和抗体有一些关联,它也有V区和C区,并能识别多种多样的抗原分子。但是TCR和BCR的最重要的区别在于TCR并非自身识别并结合抗原分子,而是识别由MHC分子递呈的短肽(short peptide fragments of protein antigens)。MHC分子表达于宿主细胞的表面。
MHC分子是由主要组织相容性复合体(MHC/major histocompatibility complex)编码的跨膜糖蛋白(transmembrane glycoproteins)。MHC分子最具特征性的结构是胞外部分的裂口(cleft),MHC分子呈递给TCR的蛋白就结合在这个裂口结构中。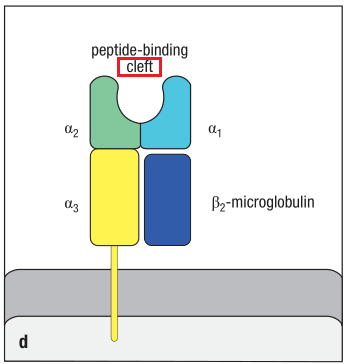
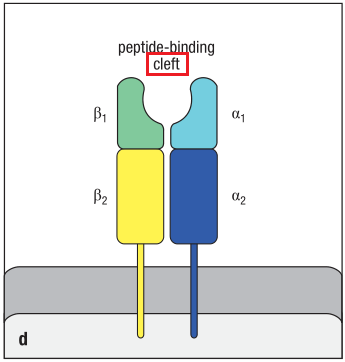
MHC分子的cleft示意图,左为MHCⅠ类分子,右为MHCⅡ类分子。
MHC分子具有多型性(polymorphic)——群体中的每种MHC分子都有不同的版本(versions),由单个基因的有着细微区别的等位基因(alleles)的不同版本(version)所编码。因此大部分人都有着异质的(heterozygous)MHC分子。这意味着每种MHC分子都由一对不同的等位基因所编码,从而提升了MHC分子能够识别并结合的分子的范围。这些分子包括抗原肽和自身肽(self-peptide)。TCR同时识别MHC分子以及MHC分子所结合的抗原肽。这导致TCR识别抗原具有MHC限制性(MHC restriction),因为每一个TCR都只能结合特定的MHC所递呈的特定抗原肽。
尽管TCR和BCR对异种抗原的识别方式不同,但是它们用以完成识别任务的基本分子结构是相似的。在这章中我们将能看到这种基本的结构是怎样与抗原分子的多样性相适应(accommodate)的。
抗体分子的典型结构
抗体是BCR的分泌型。由于抗体是可溶性的并且能够被大量分泌到血液中,因此得到了大量研究。我们对BCR的认识就是从抗体的研究开始的。
抗体分子是一个大致的Y型。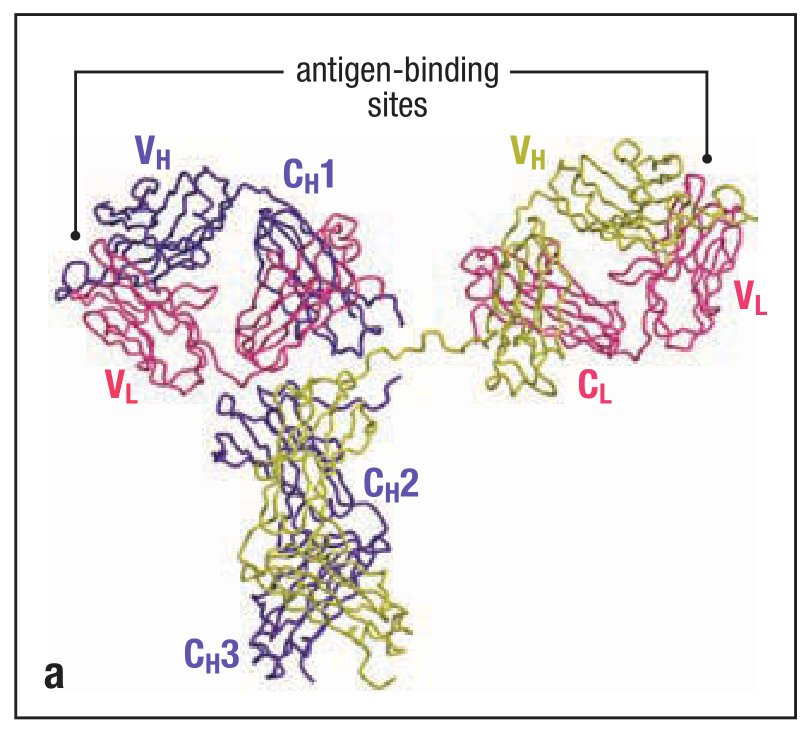
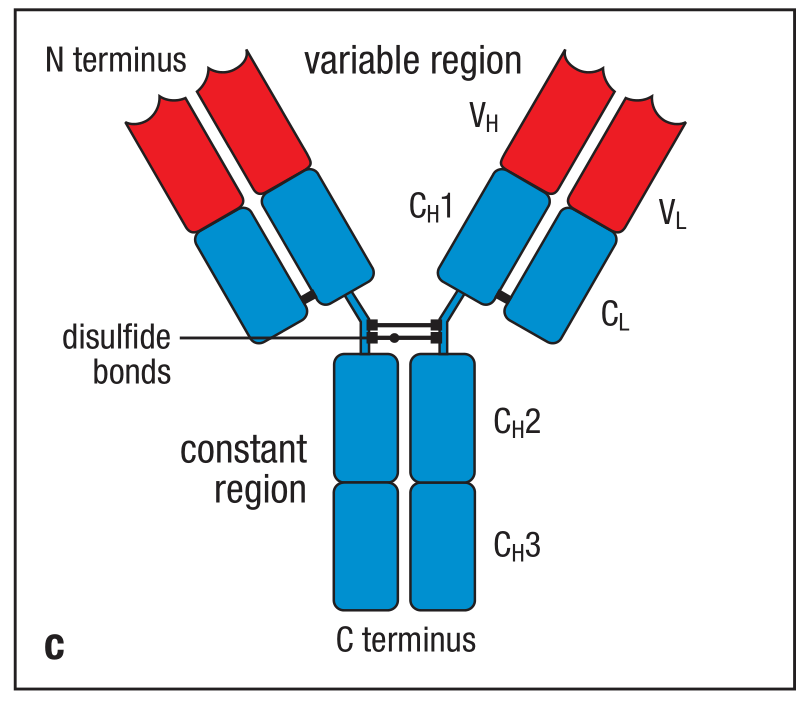
IgG抗体的X射线晶体结构(crystallographic structure)使用带状栅栏图(ribbon diagram)绘制了多肽链的骨架结构。两条重链(heavy chains)分别标记为黄色和紫色。两条轻链标记为红色。三个球形区域(globular regions)形成了大致的Y形。两个抗原结合区分别在臂的顶端(tip of arm),它们的另一端被具有韧性的(flexible)铰链区域(hinge region)固定在Y形结构的干端(trunk)。重链可变区(heavy-chain variable/V)和轻链可变区(light-chain variable/V)共同组成了抗体的抗原结合区。
这个章节中会详细解释这种Y型的结构是如何构成以及这种结构缘何能够使抗体分子既能结合抗体,又能结合效应分子和细胞从而杀灭(destroy)病原体。这些任务的完成依赖于分子的不同结构。Y的两条臂的末端——V区参与了抗原的结合。不同抗体间,V区的结构有着细微的区别。Y的干端——C区远比V区恒定,并与细胞或者效应分子相互作用。根据C区的结构和特性分类的话,抗体一共有5种类型:IgM,IgD,IgG,IgA,IgE。
所有的抗体都由一对重链和一对轻链构成。V区更精细结构的差别使其能够特异性识别不同的抗原分子。我们将会使用IgG作为例子描述免疫球蛋白(immunoglobulin)的普遍结构特性。
4-1 IgG抗体分子包含4条多肽链
IgG抗体是一个有着大约150kDa的大分子,由两种不同的多肽链构成。一个大约有50kDa,称为重链(heavy chain)或H chain,另一个约25kDa大小的为轻链(light chain)或L chain。
每个IgG分子有两条重链和两条轻链。两条重链通过二硫键(disulfide bonds)相连。对每个抗体而言,他们的两条重链和两条轻链都是完全一致的(identical),这使得每个抗体分子有两个相同的抗原结合区(antigen binding site)。因此每个抗体可以同时结合两个相同的抗原,这增加了相互作用的强度,被称为亲合力(avidity)。而单个抗原结合区和单个抗原之间的相互作用力称为亲和力(affinity)。
抗体中存在着两种类型的轻链:lamda(λ)和kappa(κ)。一个特定的抗体只能有λ或者κ链。这两种轻链之间在功能上尚未发现差异,并且它们都存在于5中类型的抗体中。它们的比例在不同的物种中存在差异。在小鼠(mice)中,κ比λ为20:1,人类中则为2:1,而牲畜(cattle)中为1:20。这种比例上的差异产生的原因还不为人知。这个比例的异常(distortions)有时被用来检测某种B细胞的克隆异常。因为某种B细胞的克隆(progeny)都有着完全一致的轻链。例如:如果检测到某个人的λ型链比例异常增高,则有可能提示有某种产生λ链的B细胞肿瘤的发生。
抗体的类型(class)和由类型决定的效应功能则依赖于抗体的重链。一共有5中重链的类型,也称为同位型(isotype)。其中的一些还有亚型(subtype),决定了抗体的功能活动(functional activity)。5种主要的抗体类型为IgM,IgD,IgG,IgA和IgE。它们的重链分别被标记为μ,δ,γ,α和ε。例如,IgM的恒定区标记为Cμ。IgG是目前发现的血清(serum)中含量最高的抗体分子,并且有着多种亚型(IgG1,2,3和4(人型))。不同类型和亚型抗体之间迥异的功能依赖于重链的羧基端(carboxy terminus)。在这个区域这条链与轻链不相关。这些同位型之间的普遍结构非常相似。
除了重链C端的一小部分羧基端有差异外,B细胞受体的结构和对应的抗体分子完全一致(identical)。在B细胞受体中,羧基端是一个疏水的氨基酸序列(hydrophobic amino acid sequence),用于将BCR固定在细胞膜上。而在抗体中羧基端是一个亲水的序列(hydrophilic sequence),使得抗体的分泌更容易。
4-2 免疫球蛋白的重链和轻链由恒定区和可变区构成
经过对许多免疫球蛋白的氨基酸序列进行检测后,确认了2点关于抗体分子的特性。第一,每条链都包含一系列相似但不完全一致的氨基酸序列,通常在110个氨基酸左右的长度。每个这样的序列都是分离的(discrete)紧密折叠的(compactly folded)区域,被称为免疫球蛋白结构域(immunoglobulin domain)或者Ig domain。轻链包含两个Ig domain,IgG的重链包含4个Ig domain。
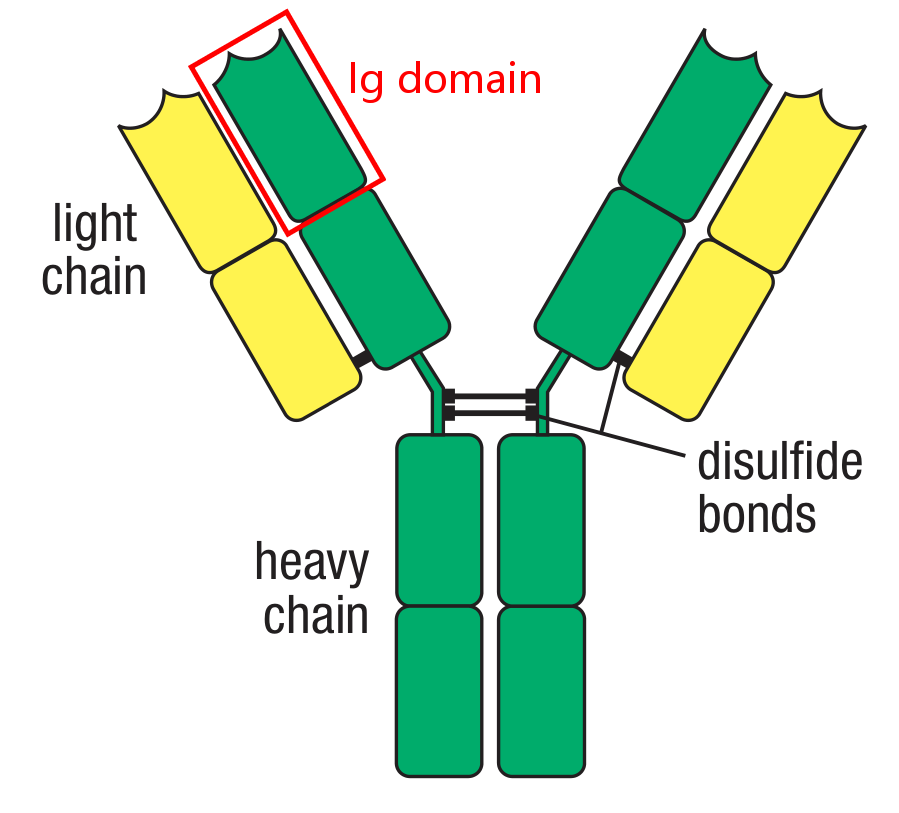
这提示免疫球蛋白的链是由重复的编码单个Ig domain的始祖基因(ancestral gene segments)演变(evloved by)而来。
第二,在不同抗体之间,轻链和重链氨基酸序列的氨基末端(amino-terminal)有着很大的差别。这些区别主要存在于前面的110个氨基酸,相当于第一个Ig结构域。其他的结构域则在同一种isotype之间保持不变。重链和轻链的V区(VH和VL)共同组成了抗体的V区,决定了抗体结合的特异性。而重链和轻链的C区构成了抗体的恒定区(constant region)。C区从氨基酸向羧基端(amino-terminal end to carboxy terminus)开始编号,如CH1,CH2,等。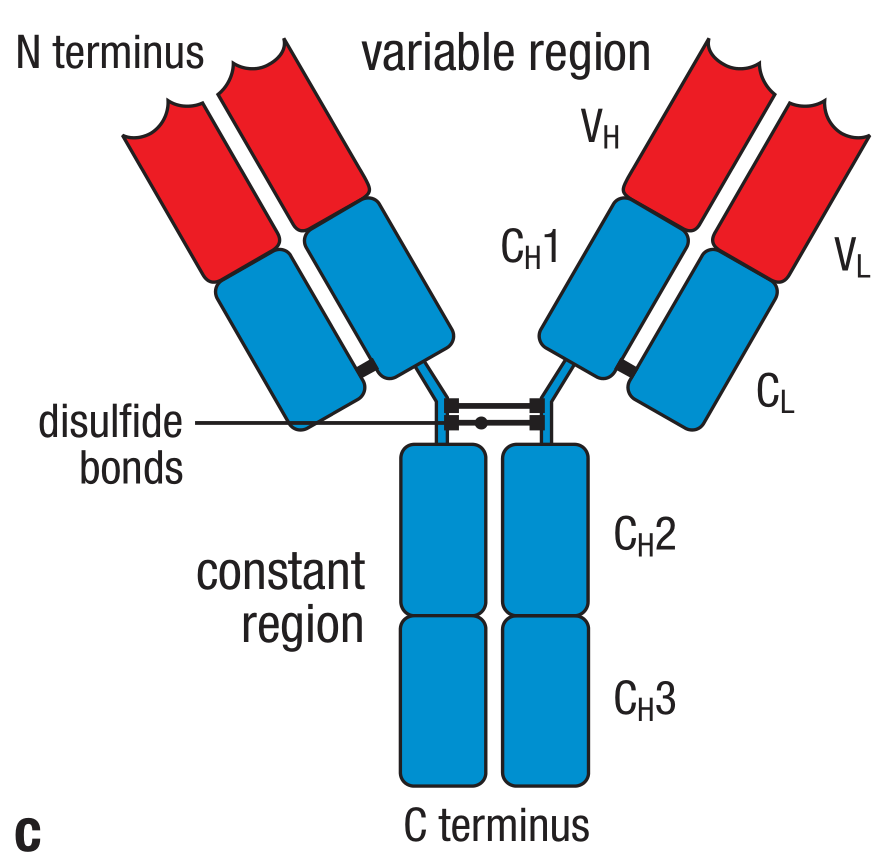
4-3 免疫球蛋白分子的结构域有相似的结构
免疫球蛋白的重链和轻链是由一系列有着相似总体(overall)结构的Ig结构域构成的。在这种基本的Ig结构域之内,V区和C区的有着显著的区别。以轻链举例如下图: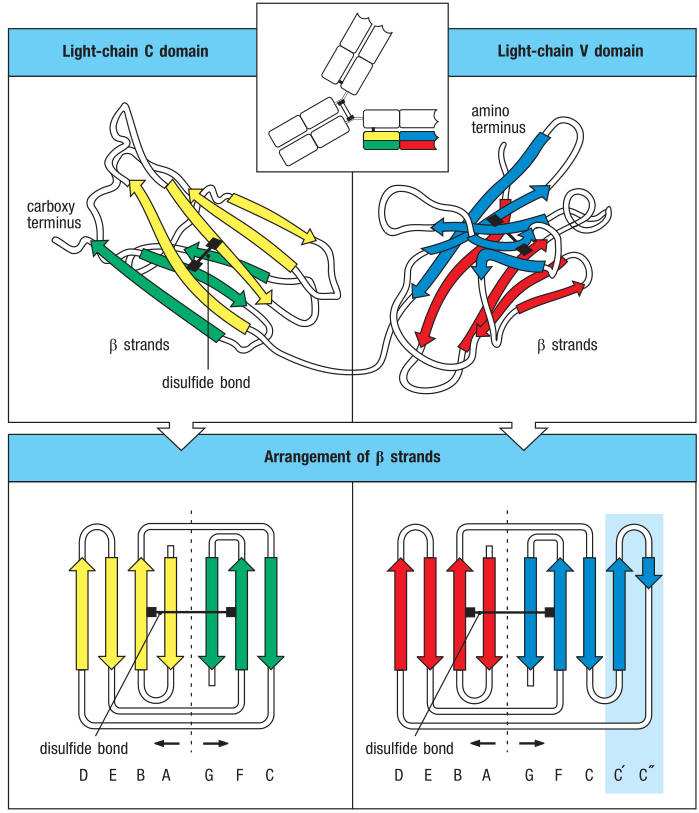
每个V或者C区结构域都是由两个β折叠(β sheets)构成的,而每个β折叠都是由数个β股(β strand)组成。β股是由很多连续的(consecutive)多肽链的骨架所构成的延展的(extended)或者平铺的(flat)构造(conformation)。在蛋白结构的展示中,β折叠常表示为“带箭头的丝带”来指示多肽骨架的方向。β股可以和附近的(adjacent)其他β股通过两个或三个柱状氢键(backbone hydrogen bonds)以“肩并肩(side-by-side)”的形式连接。这种组织形式称为β折叠。Ig结构域是由两个β折叠互相折向对方形成的,就像两片面包形成了β三明治(β sandwich)。这两个β折叠之间还通过各自的半胱氨酸(cysteine)残基形成二硫键共价(covalently)结合在一起。这个具有特征性的(distinctive)结构称为免疫球蛋白折叠(immunoglobulin fold)。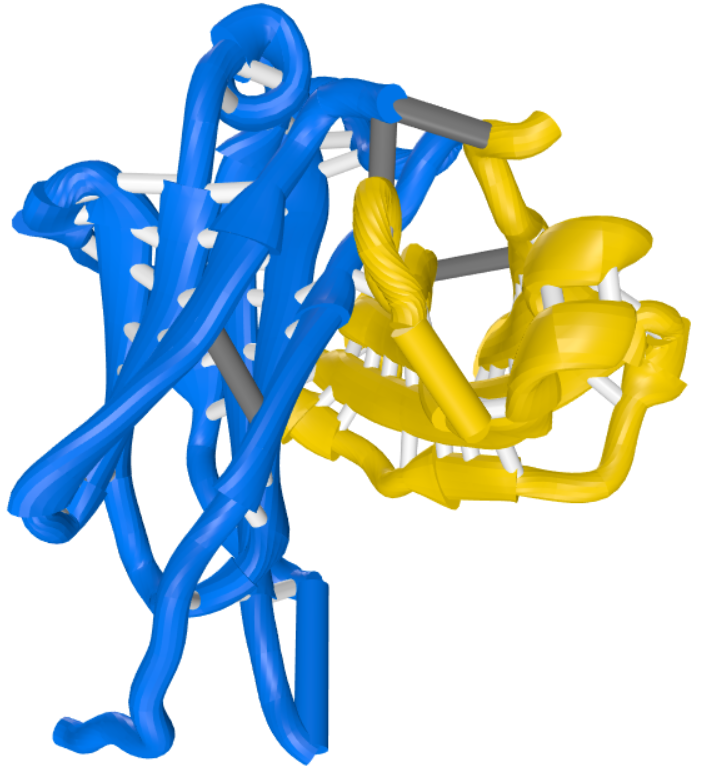
IgM C2-domain from mouse(NIH 3D Print Exchange)
在下图的红框区域可以看到C区和V区的区别和联系。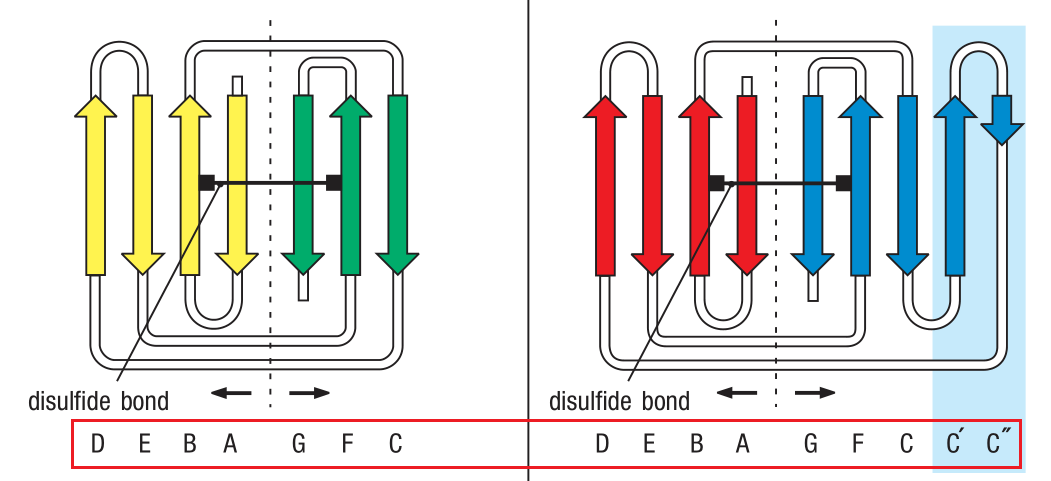
C区和V区之间最主要的区别在于V区比C区更大,并且包含额外的β strand,称为C’和C’’。在V区中,某些β strand之间形成的柔韧的(flexible)环形参与构成了免疫球蛋白分子的抗原识别区。
许多C区和V区共有的氨基酸都位于免疫球蛋白折叠的中间区域,对维持免疫球蛋白折叠这种结构非常重要。其他一些蛋白质和免疫球蛋白有相似的氨基酸序列,也有着和Ig domain(immunoglobulin fold)相似的结构域,被称为免疫球蛋白样结构域(immunoglobulin-like domain/Ig-like domain)。这些结构域在免疫系统的许多蛋白中都存在,如NK细胞表达的KIRs。它们还参与到细胞-细胞识别(cell-cell recognition)和细胞粘附,并和免疫球蛋白以及T细胞受体一起组成了免疫球蛋白超家族(immunoglobulin superfamily)。
4-4 抗体分子可以方便地(readily)被切分(cleaved)为有功能的不同片段
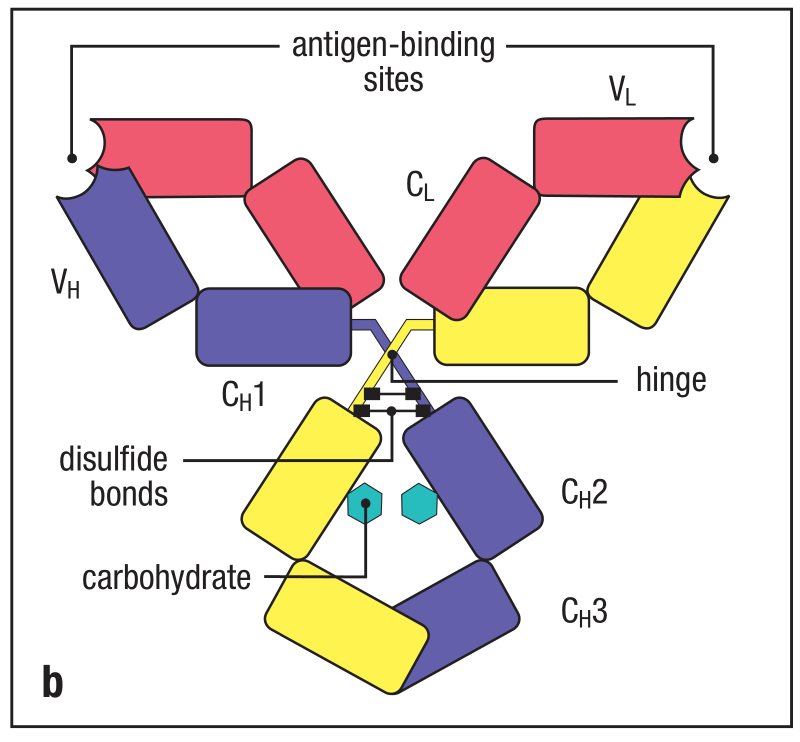
当完全合成(assembled)后,抗体分子由三个完全相同的球状部分(globular portion)构成。形状很像是两个臂(arm)通过一个柔韧伸展的多肽链连接到主干(trunk)构成的Y型。这条多肽链称为铰链区(hinge region)。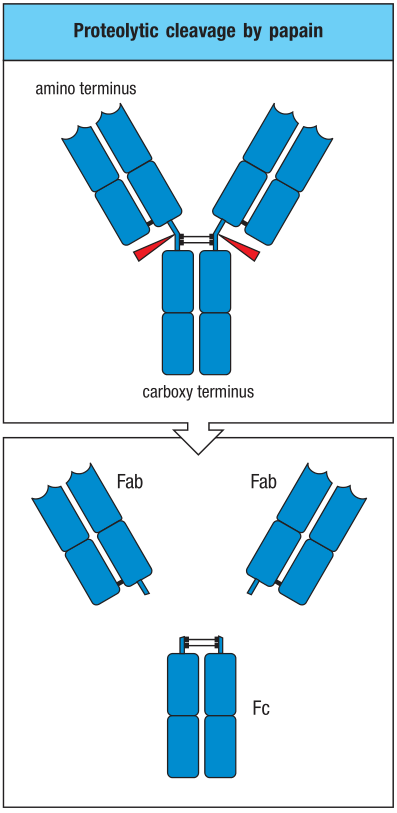
每个Y型结构的臂都是由一条轻链和一条重链靠近氨基段的1/2连接而成。重链的VH结构域和轻链的VL结构域相对(paired),CH1结构域和CL结构域相对。两个抗原结合区分别位于两条臂的末端,由VH和VL构成。Y型结构的主干则是由两条重链靠近羧基端的1/2连接而成。一对CH3结构域相互配对,但是CH2结构域之间不相互作用。(carbohydrate)

