本文内容翻译自Kuby Immunology, 7th Edition第11章“T-Cell Activation, Differentiation and Memory”。
Naive T细胞和APC细胞的相互作用是适应性免疫反应的初始事件。
T细胞激活和双信号假说
适应性免疫的初始事件是APC和初始T细胞(CD44CD62LCCR7)的相互作用。 APC,尤其在引流淋巴结、脾脏T细胞区中的APC,它们的表面能够表达MHCⅠ类和MHCⅡ类分子。CD8T细胞和CD4T细胞分别识别MCHⅠ类和MHCⅡ类分子。每个成熟的T细胞表达一个独特的抗原受体。CD4辅助T细胞的分化方向取决于与之结合的APC通过TCR所传递的信号。这些信号包括细胞因子和共刺激信号,且各不相同。信号的来源取决于PAMPs与PPRs的相互作用。
尤其CD28,参与了:①T细胞的激活;②自身免疫疾病;③翻译研究[translational research]等活动。
naive T细胞的特点:刚离开胸腺的成熟细胞,但未接触抗原,染色质紧密[condensed],无或较少的翻译[gene translational],在淋巴系统内循环,每12-24h为一个周期。这种循环增加了naive T细胞和特定抗原接触的机会。
T细胞激活和增殖需要共刺激信号
T细胞激活需要三种信号:
① MHC+TCR为基础形成的SMAC[超分子激活复合体|supramolecular activating complex]
SMAC中TCR-MHC提供基本信号,共受体和黏附分子加强信号。共刺激分子只能由APC提供。缺失APC会导致T细胞的失能[anergy]。
② 共刺激分子
例如CD28(T细胞)+CD80/86(APC)
③ 局部细胞[local]因子
包括autocrine[自分泌]和paracrine[旁分泌]
常见共刺激分子包括:
| 正向刺激 | CD28 |
|---|---|
| ICOS | |
| 负向刺激 | CTLA-4 |
| PD-1(与Treg分化相关|PD-L1在肿瘤中亦可表达) | |
| BTLA |
另外naive T细胞只表达正向共刺激分子,只有成为effector T细胞后才开始表达负向共刺激分子。
CD28
CD28的结构如下: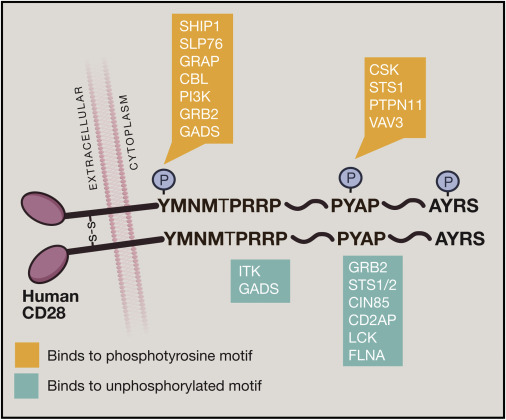
膜外基本结构为二硫键连接的同源二聚体[homodimer]。
CD28表达于大部分的T细胞。
只有专职APC[professional APC]持续表达CD80/86。巨噬细胞和B细胞只在激活后会上调CD80/86的表达。
SMAC
SMAC包括cSMAC[core SMAC]和pSMAC[peripheral SMAC]两种。以CD4T细胞为例,cSMAC包括TCR-MHC、CD4-MHC和CD28-CD80/86。其中CD4为coreceptor,CD29提供costimulatory signal。pSMAC包括{LFA-1+ICAM-1}以及{CD2+LFA-3}。pSMAC提供黏附分子的作用。
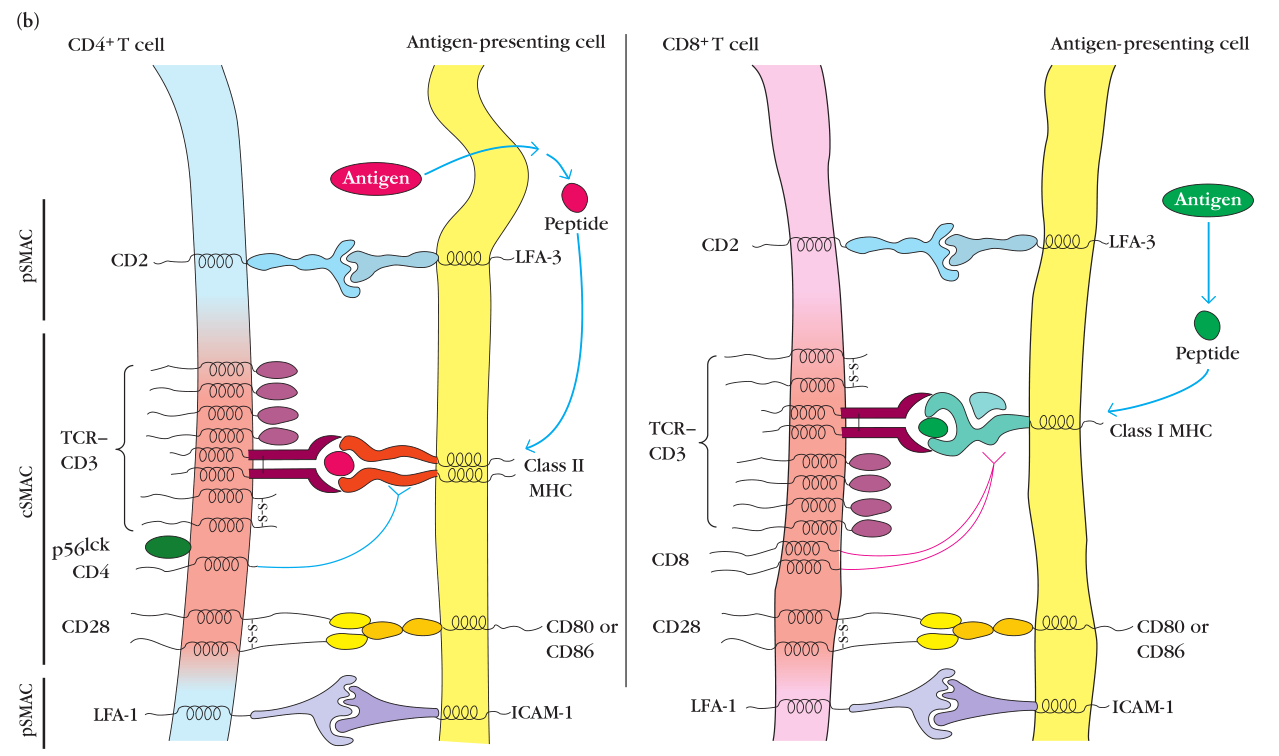
Figure 11-2 负责T细胞激活的表面分子相互作用
ICOS
ICOS表达于效应T细胞和记忆T细胞上,可能与T细胞效应和记忆功能的维持相关。
CTLA-4
CTLA-4为负性共刺激分子,在resting T细胞中不表达。在naive T细胞激活后的24h内开始表达,2-3天达到峰值。尽管CTLA-4的峰值要比CD28所能达到的峰值低,但是由于CTLA-4和CD80/86的亲和力高于CD28和CD80/86的亲和力,所以能够与CD28的正性效应对抗。
同时,CTLA-4的增加与CD28成正相关。这一现象提示CTLA-4可能能起到对CD28-CD80/86的激活“刹车”的效果。CTLA-4敲除的小鼠会呈现出如下表型:巨脾、巨淋巴结[lymphadenopathy]、出生后4周内死亡、自身免疫病。
PD-1和BTLA
PD-1和BTLA均能抑制TCR介导的T细胞激活。
PD-1在B细胞和T细胞上均有表达,可以与两类受体结合。这两类受体分别为B7-H1[PD-L1]和B7-DC[PD-L2],它们都属于CD80/86家族。B7-L2主要在APC上表达,但PD-L1的表达比较广泛,可能还在非淋巴组织中的T细胞耐受介导中发挥作用。
BTLA的分布(表达)十分广泛,在T细胞、γδT细胞、Treg、NK细胞和部分巨噬细胞、一些树突状细胞上以及大部分B细胞上都有表达。
BTLA的配体属于TNF受体家族,为HVEM[herpes virus-entry mediator|疱疹病毒侵入介体]。HVEM在许多细胞类型中都有表达。
共刺激信号的缺失导致克隆失能
经典实验: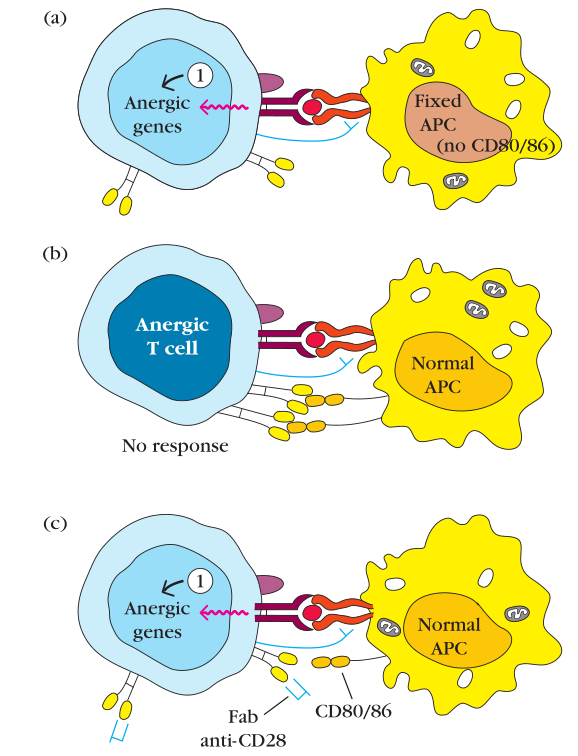
Figure 11-4 克隆失能[clonal anergy]相对于克隆扩增[clonal expansion]的实验解释
a. 当静态T细胞[resting T cell]和戊二醛固定的APC[glutaraldehyde-fixed APC]共孵时,只能产生第一信号。因为固定后的APC无法被刺激上调共刺激配体CD80/86。b. 失能后的T细胞即使与正常APC共孵,也无法从既有的失能状态中恢复。c. 当naive T细胞上的CD28被人为用anti-CD28 Fab封闭后,与正常APC共孵,也能导致T细胞失能。
在许多慢性感染(如分支杆菌、HIV、肝炎病毒等)中,抗原特异性CD8/CD4 T细胞高表达PD-1和BTLA,从而导致功能性失能[functionally anergic]。
细胞因子提供第三信号
细胞因子中最为人熟知的是IL-2。
共刺激信号(第二信号)激活后,引起IL-2和CD25(高亲和力IL-2R的α链)的转录,同时增强IL-2 mRNA的稳定性。转录的增强与mRNA稳定性的增加使得激活后的T细胞中IL-2的表达有了100-fold的提升。IL-2分泌后能与高亲和力的IL-2R结合,引起已激活T细胞的旺盛增殖。
细胞因子经由APC、T细胞、NK细胞和其他细胞分泌后都可作为第三信号。第三信号不止有增强增殖的作用,同时也决定了初始T细胞向哪种效应细胞分化。
APC拥有多种共刺激特征
尽管几乎人体内所有细胞都能表达MHCⅠ类分子,但是只有3种专职APC(树突状细胞、激活的巨噬细胞、激活的B细胞)能够表达T细胞激活所需的第二信号。同时,除了专职APC外,也只有胸腺上皮细胞能够表达共刺激配体。
次级淋巴器官中,免疫反应的早期,T细胞接触两种专职APC:树突状细胞和激活的B细胞。细菌的成分经由成熟树突状细胞的模式识别受体[PRRs]激活。激活后的树突状细胞在T细胞区分布。这些激活后的树突状细胞通过高水平的MHCⅠ类和MHCⅡ类复合体表达抗原肽。同时也表达能强力[potent]激活CD4/CD8T细胞的共刺激配体。
滤泡中的静息B细胞在通过BCR与抗原结合后获得激活T细胞的能力。在这个过程中,B细胞的MHCⅡ类分子和CD80/86上调,使得B细胞可以在T细胞区和滤泡的交界处[border]向CD4T细胞传递抗原。
由于B细胞具有通过BCR内化[internalize]抗原并通过MHCⅡ类分子呈递抗原的能力,因此B细胞是最有效激活抗原特异性CD4T细胞的APC。B细胞对CD4T细胞的激活发生在T细胞区与相邻淋巴滤泡的边界,也使得抗原特异性的CD4T细胞能够辅助B细胞的增殖、分化和记忆的形成。
巨噬细胞在次级淋巴器官和外周组织中广泛存在,也需要在激活后才能发挥APC的作用。与抗原的相互作用上调了巨噬细胞中MHC分子和共刺激配体的表达。IFN-γ等由其他细胞分泌的细胞因子也能提供相同的作用。
已知的APC和巨噬细胞仅有数种,但是它们的功能仍在探索中。它们其中的一些可能有激活或诱导效应T细胞分化的功能,另外一些有在组织(外周组织)中再激活记忆细胞的能力。另外一些可能帮助了降低免疫反应的作用,而非激活或辅助作用。全面地理解APC的作用仍需更多的研究。
超抗原是一类特殊的T细胞激活物
超抗原是指同时与T细胞受体的Vβ区以及MHCⅡ类分子的α链结合的病毒或细菌蛋白。Vβ区是由小鼠中20种不同的Vβ基因编码的。在人类中,编码这个区域基因的数量达到了65种。
每个超抗原对Vβ区域有“特异性”[specificity]。最多有5%的T细胞都可以表达Vβ区域。这种钳式的连接能够起到(模拟)TCR-MHC的作用并介导无需TCR特异性的T细胞激活。但是超抗原的激活仍需要专职APC提供第二信号。
目前发现的超抗原包括内源性超抗原和外源性超抗原。外源性超抗原是细菌分泌的可溶蛋白。其中有很多都是革兰阳性菌分泌的外毒素,比如葡萄球菌肠毒素、人毒性休克征毒素、表皮剥脱性皮炎毒素。这些毒素都与特定的Vβ序列结合并能将TCR交联到一个MHCⅡ类分子上。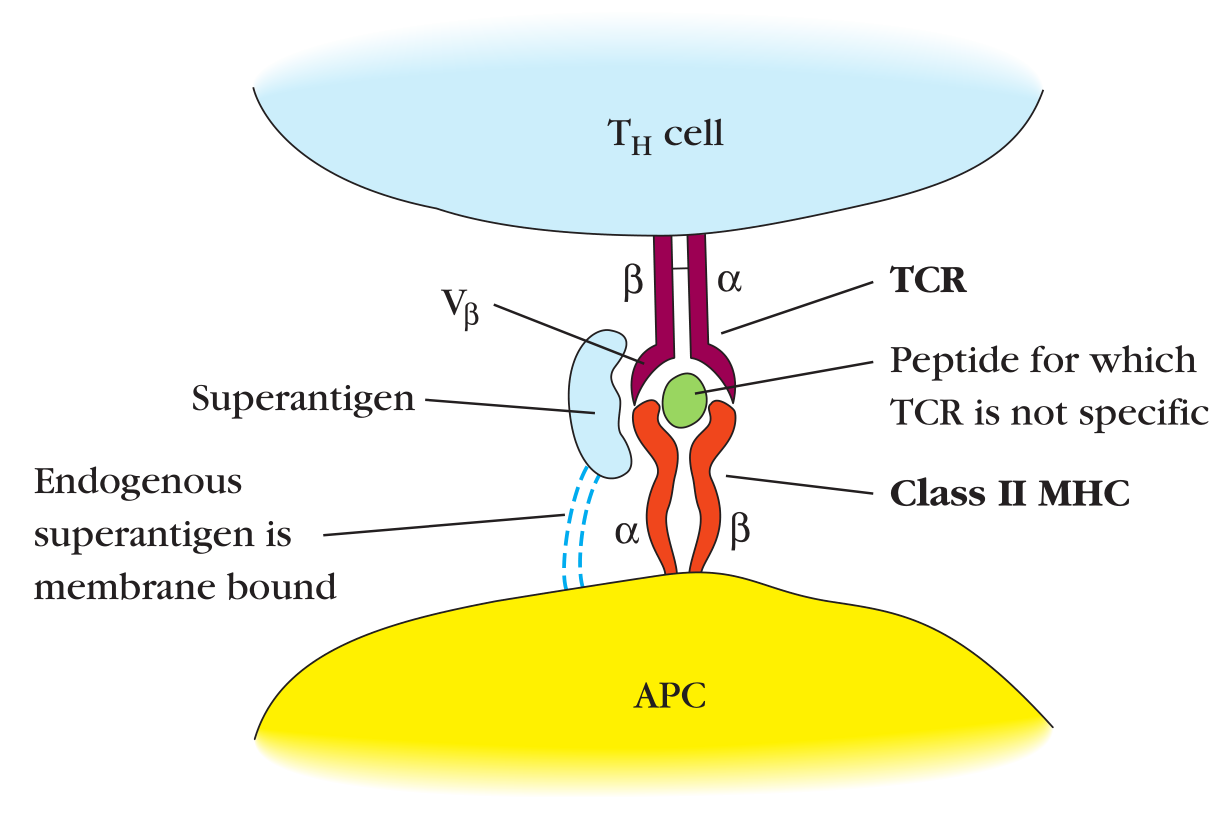
Figure 11-6 超抗原介导的T细胞受体和Ⅱ类MHC分子交联
内源性超抗原是已经整合进哺乳动物基因组的病毒基因表达的膜蛋白。其中一组内源性超抗原是由鼠类乳瘤病毒[MTV]整合进近交系[inbred strain]小鼠的DNA中所表达的,称为次要淋巴细胞刺激决定簇[Mls determinants|minor lymphocyte-stimulating determinants]。已经有不同鼠类乳瘤病毒系的4种次要淋巴细胞刺激决定簇被确认。由于超抗原独立于TCR刺激之外,因此它对T细胞的激活是多克隆的,会导致大量T细胞激活和大量T细胞因子释放,产生全身[systemic]毒性。由肠毒素引起的食物中毒和由中毒性休克征毒素引起的中毒性休克征就是两例超抗原导致细胞因子过量释放的例子。
既然超抗原会导致T细胞的大量激活和增殖,为什么病原体要产生它们呢?答案并不清晰,但是有证据提示这种激活产生的非特异性T细胞激活和炎症妨碍了抗原特异性反应的产生。而抗原特异性反应才是抵御感染最有效的方式。一些人猜想大量细胞因子的释放岁还了免疫相关的细胞和微环境,使得正常的免疫反应无法启动。另一些人认为这些超抗原的效应引发了病原体对T细胞的耐受。
T细胞分化
Naive T细胞和APC是怎样相互作用从而产生具有效应功能的细胞的呢?APC和Naive T细胞的激活和共刺激相互作用通常持续6-8小时。这么长的时间已经足够信号的级联反应产生并影响基因表达从而使Naive T细胞分化为多种效应和记忆亚群了。只有很少一部分TCR-MHC的作用能激发足够强的第一信号并与共刺激信号、高度表达的第三信号共同作用,调控以下过程:①细胞存活;②细胞周期进出;③细胞分化。
在与树突状细胞在次级淋巴器官的T细胞区接触后的1-2天里,Naive T细胞会增大为胚细胞[blast cell]并开始反复的细胞分裂。同时,有利于细胞存活的基因如Bcl-2和另外一些基因如IL-2、CD25都开始提高表达。共同作用的结果是T细胞的激活和强力的增殖。激活的T细胞每天分裂2-3次,持续4-5天。这些细胞最终分化为效应和记忆T细胞。
CD8细胞离开次级淋巴组织并在体内循环,结合、杀伤感染的细胞。CD4辅助T细胞分泌细胞因子,与其它细胞如B细胞、巨噬细胞、其他T细胞等协同作用。一些CD4T细胞,尤其是“辅助”B细胞的CD4T细胞,以及产生记忆功能的CD4T细胞,会驻留在次级淋巴组织中继续调节反应。其余的CD4T细胞则回到感染的部位加强巨噬细胞与毒性T细胞的作用。
效应T细胞是短寿的,通常存在数天到数周。但是激活后的T细胞能产生长期存活的T细胞并驻留于次级淋巴组织或外周组织中。在关键[significant]时期,为二次感染提供防护。
效应T细胞比预期的种类更多,且每一种效应T在免疫反应中都有重要的意义。第一种被识别出的其他类型的T细胞是CD4和CD8T细胞中的某种亚群。激活后的CD8T细胞获得了介导靶细胞死亡的能力,称为“毒性”T淋巴细胞。(CTL或T)。因为T细胞能识别表达于人体几乎所有细胞的MHCⅠ类分子上结合的蛋白,它们能够完美地清除被病原感染并导致T激活的细胞。另一方面,激活的CD4T细胞能获得分泌激活和增殖其他细胞的细胞因子的能力。具体而言,CD4T细胞分泌的细胞因子可以调节B细胞的激活和抗体的产生,增强巨噬细胞的噬菌作用[phagocytic]、抗菌作用[anti-microbial]、毒性作用[cytolytic]和抗原呈递作用。同时这些细胞因子也在B细胞和CD8T细胞的记忆形成中发挥作用。
由于免疫学研究者们已经发展并应用了很多工具来分辨辅助T细胞所分泌的蛋白,现在已经很明了的确认CD4T细胞的种类很多,会分化为几种不同的亚群,每种都有独特的细胞因子分泌特征。CD4T细胞分泌的细胞因子可以作用于自身(自分泌),也可以与相邻的细胞的受体结合发挥作用(旁分泌)。接下来会介绍最具特征性的数种CD4T细胞的特征和功能。尽管CD8T细胞也能分泌细胞因子,并且也有意见认为CD8T细胞也能分化成除杀伤作用T细胞以外的亚群,但比较明确的是,CD8T效应细胞的功能多样性与CD4T细胞相比明显受限。
辅助T细胞会分化为不同的亚群
Tim Mosmann、Robert Coffman和他们的同事是最早揭示辅助T细胞的表型[phenotype]和功能比最初设想的更多样的研究人员。早期的研究提示辅助T细胞能分泌多种多样的细胞因子。然而Mosmann和Coffman定义性地将其分为T1和T2两个亚群,每个亚群分泌不同种类的细胞因子。他们同时证明这种分泌模式的不同都来自相同T细胞的克隆。每个激活的T细胞发展为某一群分泌特定细胞因子的效应T细胞。
他们的实验室具体地发现了在小鼠被免疫后,从它的脾中分离出的T细胞发展为超过50多种不同的受体特征的类型。在当时,分辨大多数细胞因子的技术并不成熟,然而他们机智地将不同细胞根据细胞因子的分泌模式进行了分类。最终,他们发现50多个T细胞克隆被分为两个类别,并命名为T1和T2。
由于T1和T2是由小鼠脾脏中的T淋巴细胞在体外产生的克隆,因此有人质疑在体内环境中会不会有其他情况。比如有没有可能T1和T2只是同一细胞系的不同阶段,而且其他物种或许不止有这两种亚群。同时,早期人体中无法定位[locate]这两种亚群,以致于人们认为T1和T2以及其他CD4T细胞亚群在人体中是不存在的。后来的研究更正了这一观点。在许多体内系统中,T细胞向T1、T2分化的时间较晚。因此,在健康人体中很难找到T1和T2细胞。事实上,T1和T2细胞基本上在患慢性感染性疾病和过敏性疾病的慢性期中都能找到。
现在的技术使得我们可以清楚地理解不同组的细胞因子分泌模式。T1可以分泌IL-2、IFN-γ、TNF-β,与经典的细胞介导的功能相关。如T和巨噬细胞的激活。T2能分泌IL-4、IL-5、IL-6、IL-9、IL-10、IL-13并调节B细胞的活动和分化。
过去10年的CD4T细胞的研究证明CD4T细胞在激活后至少能分化为5种不同的亚群:T1、T2、T17、T和T。
为了更好地描述CD4T细胞的功能,我们需要回顾病原体对组织的免疫过程。Naive T细胞最终分化为哪种类型的CD4效应T细胞很大程度上取决于感染的类型。比如,胞外细菌感染会导致激活的CD4T细胞向T2细胞分化,从而辅助B细胞激活并分泌抗体来发挥调理[opsonize]和中和毒素的作用。另一方面,由胞内病毒或细菌引起的感染会导致向T1细胞的激活,从而增强巨噬细胞和CD8T细胞的毒性作用,杀伤受感染的细胞。对真菌感染的免疫响应会导致CD4T细胞向多种类型分化。事实上,感染都会导致多种辅助T细胞亚群的分化,其中一些亚群的功能有重合的情况。
辅助T细胞亚群的分化受分化细胞因子[polarizing cytokine]的调控
既然我们已经知道TCR和共刺激分子参与了T细胞的激活,而这两者都是由激活的APC提供的,那么很明显导致T细胞功能分化的原因就是免疫反应中的细胞因子(第三信号)。因为这些细胞因子负责了辅助T细胞向某种效应功能亚群的分化,因此也叫分化细胞因子。例如,在存在IL-12和IFN-γ的环境中激活的T细胞更容易分化为T1细胞。而在存在IL-4和IL-6的环境中激活的T细胞更容易分化为T2细胞。
分化细胞因子可以由APC(stimulating APC)自身产生,也可以由被病原体激活了的邻近免疫细胞产生。免疫反应中产生哪一类细胞因子取决于1. 来源细胞(DC,巨噬细胞,B细胞,NK细胞等);2. 细胞的成熟程度和激活状态;3. 遇到的是哪种抗原和炎症介质[inflammatory mediators];4. 在哪种组织中遇到的抗原。因此天然免疫在适应免疫过程中也发挥着重要的作用。如下图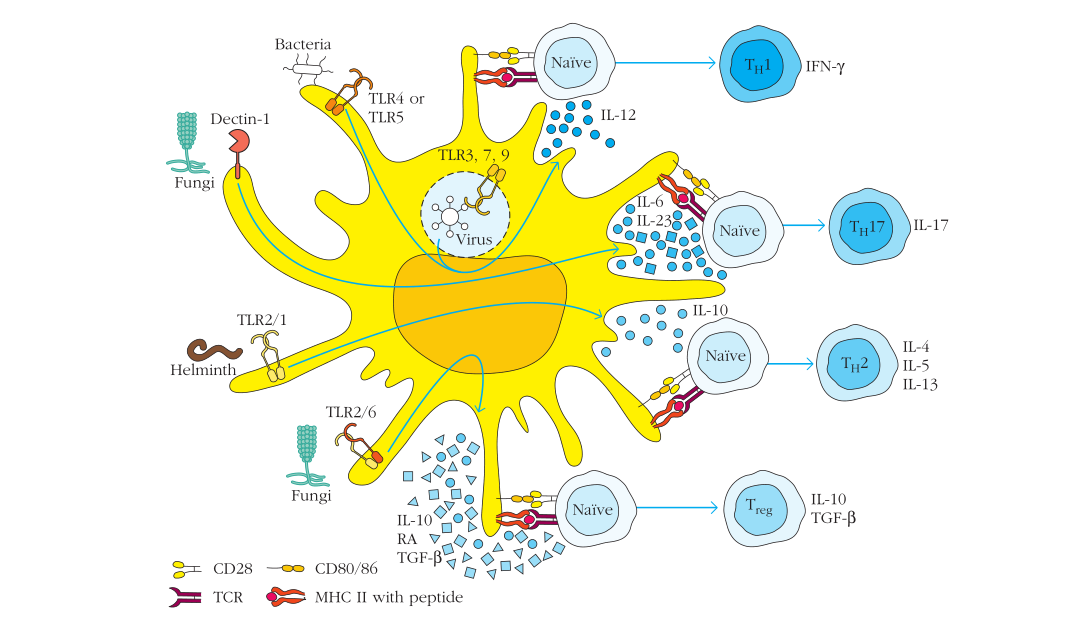
Figure 5-18 通过APC PRRs 的分化信号影响辅助T细胞的功能
特别的是,通过影响与T细胞相互作用的APC细胞因子的分泌、APC细胞膜和微环境的状态,能够直接影响辅助T细胞的功能命运[functional fate]。
回顾第5章,APC和其他固有免疫细胞的激活的激活信号是来自于和感受病原压力的PAMPs相互作用。这些PAMPs和PRRs结合。PRRs包括但不限于Toll样受体[TLRs]。PRR激活APC并提高了APC的MHC和共刺激分子的表达。PRR也同时决定了树突状细胞和其他免疫细胞会哪种细胞因子。因此PRR信号可以调控T细胞激活后的命运[fate]。如下图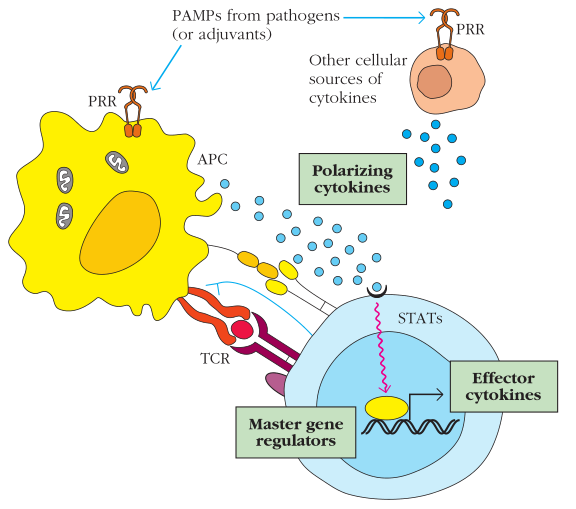
Figure 11-8 驱使T细胞分化的常见事件和因素
例如,许多病毒的产物中的一种——双链RNA[double stranded RNA],可以和树突状细胞上的TLR3受体结合,启动级联信号[signaling cascade]并最终导致IL-12的产生。IL-12可以直接促使向T1的分化。另一方面,蠕虫[worms]可以激活固有免疫细胞上的PRRs。肥大细胞(一种固有免疫细胞)可以产生IL-4,IL-4可以直接促使激活的T细胞向T2分化。T2能协调IgE反应,从而杀伤寄生虫。在这个例子中,主要的分化细胞因子不是由激活T细胞的树突状细胞产生的,而是由邻近的免疫细胞产生。决定辅助T细胞分化方向的分化细胞因子是由怎样的抗原相互作用产生的非常复杂,也是研究的热门领域。
数十年间,佐剂一直用于提升疫苗的效果。现在已经知道疫苗佐剂可以通过调节APC细胞共刺激配体和细胞因子的表达来影响固有免疫系统,并最终影响T细胞激活的结果。通常认为PAMPs和由APC自身分泌的细胞因子(如IL-12)是天然的佐剂。死亡的分支杆菌能够激活许多PRRs,可以作为小鼠免疫反应中的强力佐剂使用。几乎没有佐剂证实可以在人体疫苗中使用,但是小鼠上的这种现象给了我们对刺激PRRs的分子以及刺激的作用更深入的了解。研究者们期待有一天我们能够通过改变佐剂来调节人体对疫苗抗原的效应状态。
效应辅助T细胞亚群之间可以通过三个特点区分
每个辅助T细胞亚群都是由一系列特性所定义的。这些特性的细节对免疫学的入门者而言十分复杂。了解这些细节是理解每个细胞亚群在感染和感染性疾病所扮演角色的第一步。在阅读和理解更高层次的文献时也需要有这些信息作为参考。一些普遍的概念为理解这些细节提供了组织框架。例如这些信息:
- 每一种主要的辅助T细胞亚群都可以通过这些来描述:
- 一类独特的分化细胞因子
- 一种主要的转录调控因子
- 一种完全分化的T细胞群所产生的效应细胞因子分泌模式
- 在次级淋巴器官中,当初始前体细胞[naive precursor]与APC细胞相遇时,APC所提供信号的强度和数量决定了它向哪一个亚群分化。这种信号的强度和数量又是由APC所遇到的病原体的特性所决定。
- 宽泛的讲,T1和T17调控细胞免疫(CD8T细胞和巨噬细胞),T2和T调控体液免疫(B细胞)。然而,应该清晰地认识到,CD4T细胞也有可能为B细胞的效应提供了帮助。T1和T17通常能够促进B细胞分泌加强细胞免疫的抗体(例如,IgG2a可以“武装[arm]”NK细胞来加强其毒性作用[cytotoxicity],参见第13章)。T2细胞可以促进B细胞分泌介导清楚细胞外病原体的抗体(例如,IgE可以介导杀伤胞外寄生虫的相关分子的释放)。
- 辅助T细胞亚群之间经常“交叉调节[cross-regulate]”。它们分泌的细胞因子一般也会自身的增殖和分化同时抑制自身向其他亚群分化。比较典型的例子是T1和T2,以及T17和T。
- 辅助T细胞的系谱[lineage]或许不是一成不变的。尤其在分化的早期,一些亚群如果暴露于一组不同的细胞因子中,能够呈现出其他亚群的细胞因子分泌模式。
- 不同亚群具体的生物学功能、分化的所在和活动仍在持续的研究中。很多仍不明确。
我们继续讨论最先发现的两个辅助T细胞亚群,T1和T2的特征。它们是说明不同亚群差异和关系的一个很好的例子。这之后我们将归纳一下近期发现的亚群,T17和T和TREG的相关研究发现。
T1和T2的分化和功能
介导naive T细胞向T1细胞分化的关键分化细胞因子是IL-12、IL-18和IFN-γ。见下图:
Figure 11-9 TH1和TH2亚群分化的调控
在树突状细胞通过PRRs(例如TLR4,TLR3)识别病原体后会分泌IL-12。激活的T细胞、NK细胞所分泌的IFN-γ同样可以刺激树突状细胞分泌IL-12。树突状细胞还能分泌IL-18,IL-18可以促进树突状细胞自身的增殖和IFN-γ的分泌。这些分化细胞因子可以增强主要基因调控因子[master gene regulator]T-bet的表达。T-bet介导了向TH1的分化,同时也介导了TH1的效应因子比如IFN-γ和TNF的表达。
IFN-γ是一种强力的效应细胞因子,它的分泌可以激活和刺激巨噬细胞,增强其杀菌活动[microbicidal activity]、MHCⅡ类分子的表达和IL-12的分泌。IL-12的分泌反之又能促进TH1的分化。IFN-γ也可以促进抗体类型向IgG转换(比如小鼠的IgGα)。IgG能促进吞噬作用[phagocytosis]和补体的固定[fixation of complement]。最后,IFN-γ可以通过激活与naive TC细胞相作用的树突状细胞,促进CD8+T细胞向细胞毒性TC细胞完全分化。
以上这些效应功能使得TH1细胞尤其适合响应病毒感染和其他胞内病原体侵入以及由常春藤毒素[poison ivy]引发的延迟型超敏反应。
正如TH1细胞亚群的分化是由IL-12和IFN-γ所驱动,驱动向TH2亚群分化的分化细胞因子则是IL-4(图11-9)。在免疫反应的初始阶段,将naive辅助T细胞用IL-4处理,会使其向TH2细胞分化。有趣的是,TH2细胞远比TH1更容易发生和发展[development]。即使环境中存在IFN-γ和IL-12,如果有IL-4的话,naive T细胞也会向TH2效应细胞分化。IL-4会激活T细胞内的一条以GATA3为核心调控基因的信号通路,GATA3的高表达反之能够调节TH2特异性的细胞因子,如IL-4,IL-5和IL-13。
树突状细胞不产生IL-14,那么IL-14是哪里来的呢?在外周组织中,在遇到病原后,肥大细胞、嗜碱性粒细胞和NKT细胞能够产生IL-14并影响外周T细胞的命运。GCB[生发中心B细胞|Germinal-center B cells]和T细胞也能分泌IL-14,从而影响淋巴结和脾脏中的辅助T细胞分化方向。同时,TH2细胞自身也可以大量分泌额外的IL-4来增强分化进程。研究者们仍在探索次级淋巴组织中使得naive T细胞向TH2分化的IL-4的来源。
TH2细胞所分泌的效应细胞因子能否辅助清除胞外的寄生虫感染。IL-4这个TH2细胞的决定性效应细胞因子,能够作用于B细胞和嗜酸性粒细胞。IL-4能够介导嗜酸性粒细胞的分化和激活,也能增强B细胞的激活和抗体类型向IgE转换。因为嗜酸性粒细胞能够表达IgE的受体FcεR,IgE和FcεR的结合能够释放有效杀伤蛔虫的炎症介导因子[inflammatory mediators],因此IL-4介导的这两种细胞功能具有协同效应。同时,IgE抗体能够在蠕虫和嗜酸性粒细胞之间形成一座桥梁。IgE以可变区[variable regions]与蠕虫抗原结合,以恒定区[constant region]与FcεR结合。IgE抗体也能介导过敏反应。
IL-5能够介导B细胞类型转换为某种分泌IgG亚型(如小鼠中的IgG1)的浆细胞而不激活补体通路。IL-13的功能多数与IL-4重叠。最后,IL-4可以抑制TH1细胞的扩增。
T1和T2的交叉调节
TH1和TH2细胞主要的效应细胞因子分别是IFN-γ和IL-4。这些细胞因子不仅影响整体的免疫反应,还会影响辅助T细胞亚群。首先,它们能够增强对应亚群的增殖或分化,从而增加自身的分泌;其次,它们也能抑制相反亚群(opposite subsite)的发展和活动。这种调节过程被称为交叉调节。例如,TH1分泌的IFN-γ能够抑制TH2亚群的增殖,而TH2分泌的IL-4能够下调APC分泌的IL-12,从而抑制向TH1亚群的分化。此外,IL-4还能通过使TH细胞对具有诱导向TH1细胞的细胞因子响应更不敏感而增强TH2细胞的发展。反之亦然。
相似的是,这些细胞因子除了作用于辅助T细胞亚群之外,还对其他的细胞有作用效应。在小鼠模型中,T1和T2细胞的研究更加详细,我们了解到这些细胞因子对于B细胞所分泌抗体的类型具有截然不同的作用。在本书第3章和13章中提到,IgG2a能够通过武装NKT增强细胞介导的免疫效应;而IgG1和IgE能够作用于胞外病原体,增强体液免疫。T1分泌的IFN-γ能够增强B细胞分泌IgG2a同时抑制IgG1和IgE的分泌。另一方面,T2分泌的IL-4能够增强B细胞分泌IgG1和IgE同时抑制IgG2a的分泌。因此,这些细胞因子在抗体生成方面的作用是和不同辅助T细胞亚群对细胞免疫/体液免疫的作用相一致的。
TH2细胞分泌的IL-10也能抑制TH1细胞的发生发展,但并非通过直接作用而是通过与巨噬细胞和单核细胞的间接作用。IL-10能够作用于巨噬细胞和单核细胞,通过干扰它们对TH1细胞的激活而发挥作用。具体的说,是通过这三种途径:1. 抑制MHCⅡ类分子的表达;2. 例如,抑制具有杀菌作用的代谢产物[metabolites]如一氧化氮[nitric oxide]和多种炎症介导因子。甚至通过3. 介导细胞凋亡来抑制TH1细胞。
决定性的调控因子T-Bet和GATA-3也在交叉调节中扮演者重要角色。具体地说,T-Bet的表达会促使细胞向TH1亚群分化并抑制其向TH2细胞分化。而GATA-3的表达则会促使细胞向TH2亚群分化并抑制其向TH1细胞分化。最后,细胞因子能够引导同一类的这些转录因子序贯表达并抑制另一类转录因子的表达。
T17细胞
T17细胞和T1细胞一样,被发现在细胞免疫中发挥作用。某种程度上,T17的发现得益于IL-12的发现。IL-12是促进TH1细胞发展的分化细胞因子,它和IL-23同属于包含p40亚单元[subunit]的细胞因子家族。p40敲除的小鼠是研究T1细胞作用的良好模型,因为在IL-12缺失的环境中,p40敲除的小鼠不能产生T1细胞。但是当研究者发现p40对IL-23的产生也很重要之后,这种现象的机制就更加明确了。事实上,缺失p40的小鼠不仅影响了T1细胞的产生,也影响了另一种分泌IL-23的辅助T细胞亚群的产生的发展。有一些之前认为是分泌IL-12的T1细胞的效应功能事实上是由分泌IL-23的另一种辅助T细胞所维持的。这种细胞亚群就是T17。
当naive T细胞在存在IL-6和TGF-β的环境中激活后,会趋向于分化为T17细胞。TGF-β也是iT关键的分化细胞因子(参见Figure 11-11)。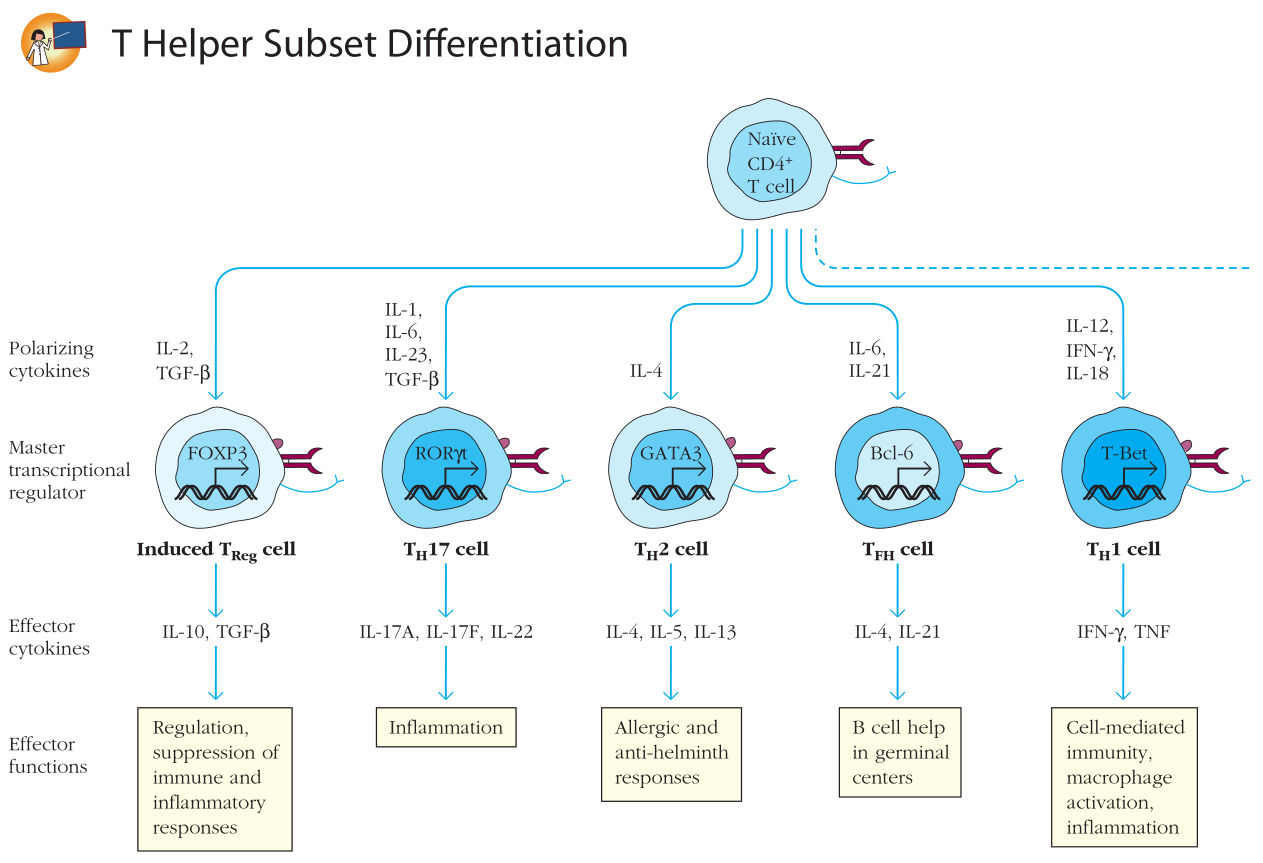
Figure 11-11 辅助T细胞亚群分化
IL-23也在T17的最终命运决定中发挥作用。APC在PAMPs与真菌壁成分如TLR2、CLR Dectin-1等相互作用时分泌IL-23。TH17也有一个主要的转录调控因子——孤生类固醇受体[orphan steroid receptor] RORγt。这个受体在T细胞的发生发展中也发挥重要作用。RORγt敲除的小鼠在诱导产生实验性自身免疫脑炎[EAE|experimental autoimmune encephalitis]后,脑炎的严重程度比对照更轻微,显然是T17细胞的降低造成的。
T17细胞之所以命名为TH17是因为它能分泌IL-17A。细胞因子IL-17A和慢性炎症以及能导致炎症性肠道疾病、关节炎、多发性硬化症等疾病的自身免疫反应相关。在慢性自身免疫疾病中,T17细胞也是最主要的免疫细胞类型。T17细胞也分泌IL-17F和IL-22,这两种细胞因子都和组织炎症相关。T17细胞存在于健康人类的上皮表面(如肺上皮和肠上皮),或许对防卫真菌和胞外细菌的感染有作用。我们对T17生理功能的了解才刚刚开始,全面而系统的认识仍待进一步的研究。
(Induced)T Cells
还存在另一种类型的CD4T细胞,能够负向调节T细胞免疫反应,限制自身免疫相关的T细胞活动从而维持外周耐受。这个亚群被称为诱导的T细胞[induced T(iT)]。iT和胸腺来源的natural T[nT]细胞在功能上十分相似。但iT的来源并非胸腺,而是在次级淋巴组织中,存在TGF-β时,从激活的naive T细胞分化而来。(参见Figure 11-11)TGF-β介导FoxP3的表达。FoxP3是iTREG命运决定的主要转录调控因子。iTREG分泌效应细胞因子IL-10和TGF-β,这两种细胞因子能够通过它们对APC的抑制效应以及和T细胞直接的相互作用下调炎症反应。在健康动物中清除iTREG细胞能够引起多种自身免疫反应。这提示即使是健康的个体,也在持续的抵御自身免疫反应。近期的数据还提示,iTREG细胞在维持母体对胎儿的免疫耐受中发挥关键[critically important]的作用。
T17和T的交叉调节
正如T1和T2细胞能够相互[reciprocally]调节,T和T17之间也存在这样的情况。TGF-β能够介导向T的分化。然而,当TGF-β和IL-6同时存在时,TGF-β则介导向T17的分化。更明确的讲,TGF-β能够上调FoxP3和RORγ的表达。(FoxP3和RORγ分别控制TREG和TH17的分化)当IL-6和TGF-β同时存在时,TGF-β产生的信号则会抑制FoxP3的表达,使得RORγ成为主导的信号,从而介导向T17的分化。T17相对于T的关系是自适应的[adaptive]。在静息状态下[at rest],健康组织更希望是iT细胞的群体发挥抗炎的作用,这种iT主导的抗炎效应也能被自身分泌的TGF-β所加强。炎症反应则能介导产生包括IL-6在内的急性反应蛋白。当IL-6存在时,TGF-β的活动能够从促使T细胞向iT发展转为具有促炎[pro-inflammatory]作用的T17,进而建立[mount]适当的防御。
T细胞
滤泡辅助T细胞[Follicular helper T(T**FH**) cells]是最近才被发现和辅助T细胞亚群。T是一个独立的细胞系[lineage]还是某个其他类型的辅助T细胞的发展阶段仍存在争议。T细胞存在于B细胞滤泡和生发中心。和T2细胞相似,T细胞在为B细胞提供帮助方面发挥中心作用[central role]。然而,T细胞所分泌的效应细胞因子和T2细胞存在部分差别。
使激活的T细胞向TFH分化的细胞因子包括IL-6和IL-21,这些分化细胞因子介导了转录因子Bcl-6的表达。Bcl-6是一类转录抑制物[transcriptional repressor],也是T的主要转录调控因子。(参见Figure 11-11)交叉调节也是TFH功能的一种特征:Bcl-6的表达抑制T-bet、GATA3和RORγt的表达,从而在介导向TFH分化的同时抑制向TH1、TH2和TH17的分化。
T和T2都分泌IL-4,但能够介导B细胞分化的IL-21是TFH所分泌的更具特征性的细胞因子。有趣的是,T和T2都能产生IFN-γ(T1决定性[defining]的细胞因子)。T和T2在介导B细胞抗体产生方面的作用是如何产生差异的仍是未知的问题。
其他潜在的辅助T细胞亚群
另外一些有独特分化条件[polarizing requirements]和细胞因子分泌模式的T细胞亚群已经被发现了。(例如分泌IL-9和IL-10的T9细胞)然而,由于这些细胞亚群所分泌的细胞因子也能由T1、T2、T17或iT分泌,一些人认为这些细胞类型并非不同的亚群,而是某种主要亚群细胞的发展阶段或者功能的变体[variants]。这种观点事实上已经用在了滤泡辅助T细胞[T]上。T分泌的细胞因子也能由其他类型的辅助T细胞亚群所分泌。不过,由于这个亚群有一个独特的基因标签[gene signature]和一个独特的主要调控因子(Bcl-6),因此大部分人仍认为T确实是一个独立的细胞系。
辅助T细胞亚群之间或可互相转化
研究者们现在认为,辅助T细胞的不同亚群之间的关系要比人们之前所认为的复杂。至少在分化的早期阶段,辅助T细胞可以转变他们的命运决定并分泌另一种亚群的细胞因子。例如,当早期的[young]T2细胞暴露于IL-12中时,可以被诱导表达TH1细胞的特征性细胞因子IFN-γ。同样,当早期的[young]T1细胞暴露于TH2的分化细胞因子中时,也可以被诱导表达TH2细胞的特征性细胞因子IL-4。
有趣的是,TH1和TH2都无法获得TH17或者iTREG的特性。而TH17和iTREG则更加灵活[flexible],可以转变为包括TH1和TH2在内的多种辅助T细胞亚群的细胞因子分泌模式。TH17亚群或许是最不稳定的细胞系。依赖于不同的环境输入,可以被诱导分泌IFN-γ和IL-4。一些iTREG也可以被诱导分泌IFN-γ,另一些在暴露于IL-6和TGF-β后可以被重定向为TH17的表型。这种亚群之间的流动性[fluidity]使得建立一个单独的辅助T细胞系十分困难。事实上,一些逐渐发现的亚群可能是T1、T2、T17和iT暴露于某些分化细胞因子环境中所呈现的不同变体[variants]。
辅助T细胞亚群在免疫健康和疾病中发挥重要作用
在小鼠和人体中的研究都表明T细胞亚群之间的平衡能够显著地影响免疫反应的结果。一个经典的例证是由分枝杆菌[mycobacteria]所致的麻风病。分枝杆菌是一种胞内病原体,可以存活于巨噬细胞的吞噬小体中。麻风病并非单独的临床个体[entity],而是代表着临床反应谱系[spectrum]。在谱系的终点,两种主要的形式是结核型[tuberculoid]和瘤型[lepromatous]。在结核型麻风病中,细胞介导的免疫清除了绝大部分的分支杆菌。尽管皮肤和外周神经受到损伤,但是疾病的进展十分缓慢,病人往往能够存活。相反,瘤型的特点是体液免疫占据主导,细胞免疫受到抑制。体液免疫反应有时会导致明显高水平的免疫球蛋白(高丙球蛋白血症[hypergammaglobulinemia])。这种反应在抵御疾病方面并不有效,分支杆菌常常广泛的感染[disseminated in]巨噬细胞。受感染的巨噬细胞数量通常能达到每克组织中10个。瘤型分枝杆菌能够进一步感染骨组织、软骨组织并导致更严重的神经和组织损伤。
结核型或瘤型分支杆菌感染部分依赖于T1和T2反应的平衡。(参见Figure 11-12)
Figure 11-12 麻风病类型和TH1、TH2活动之间的关联
在结核型麻风病中,免疫反应主要是T1型反应,伴随着高循环水平的IL-2、IFN-γ和LT-α[Lymphotoxin-α]。在瘤型麻风病中,免疫反应主要是T2型反应,伴随着高循环水平的IL-4、IL-5(以及TH2也可以分泌的IL-10)。瘤型麻风病中的这种细胞因子模式反映出减弱的[diminished]细胞免疫和增强的血清抗体水平。
想必这些病人都是被同一种病原体所感染,为什么一些成功的建立了T1反应,而另一些没有呢?有研究提示人类宿主之间的基因差异或许是一个原因。例如,易感性的差异或许和个体固有细胞上PRRs(TLR1和TLR2)的表达相关。这说明病原体和固有免疫细胞之间的相互作用决定了细胞因子环境并影响了T细胞分化的结局。TLR表达的差异或活动能够影响所产生细胞因子的质和量。
HIV感染后向艾滋病的发展或许也受到辅助T细胞平衡的影响。在疾病的早期,T1的活动较高。但是一些研究提示,随着艾滋的进展T1样的反应会转向T2样的反应,而T2主导的免疫反应控制病毒感染的能力更弱。另外,一些病原体可能会“有意的[purposely]”影响T细胞亚群。例如,EB细胞能够产生生人类IL-10的类似物,称为病毒IL-10(vIL-10)。与胞内IL-10相似,vIL-10趋向于通过抑制巨噬细胞的趋向激活[polarizing activity]抑制T1的活动。一些研究者猜测vIL-10或许能够减弱针对EB病毒的细胞免疫活动,从而使得EB病毒更易存活。
T17细胞最先是因为和慢性自身免疫疾病相关而受到人们的关注。IL-23是有助于向T17细胞分化的细胞因子,当小鼠不能产生IL-23时,能够高度抵抗[remarkably resistant]对自身免疫病。T17细胞和定义它的细胞因子IL-17是在风湿性关节炎、炎性肠病、多发性硬化症和哮喘患者的炎症组织中找到的。但是T17细胞在感染中是如何保护组织的仍不明确。一些研究使用常染色体控制的[autosomal dominant]疾病(也被称为高IgE综合症[Hyper-IgE syndrome]或Job syndrome)个体,证实了在小鼠真菌和胞外细菌感染的控制中T17细胞起到了重要作用。
这些疾病和在第15、16章中描述的疾病只是辅助T细胞亚群在疾病发展中发挥影响的部分实例。需要认识到的是,目前我们对于辅助T细胞在健康和疾病中所发挥作用的了解仍非常浅薄[simplistic]。现在开展的许多的关于亚群的复杂性[complexity]和它们之间关联[interplay]的研究将会让我们在未来有更明确的认识。
T细胞记忆
T细胞的激活会导致强力的增殖、效应细胞的产生,而后细胞数量会有大幅的收缩[contraction]。在病原体被清除后,至少90%的效应细胞会通过凋亡死亡,只留下非常重要的抗原特异性记忆T细胞。记忆T细胞通常是长寿且静息的[quiescent],但是在遭遇同一抗原时,反应更强。这种二次免疫反应[secondary immune response]更加迅速和强力,因此也比最初的反应更有效。
到目前为止,仅凭表型分辨效应T细胞、Naive T细胞和记忆细胞仍十分困难。一些时候,根据功能来区分它们更有效。和naive T细胞相似,大部分记忆T细胞停留在细胞周期的G0期。但是相比naive T细胞,记忆T细胞更容易被激活。例如,naive T细胞绝大多数都只能被树突状细胞激活,而记忆T细胞可以被巨噬细胞、树突状细胞或者B细胞激活。记忆细胞表达不同的表面黏附分子和共刺激受体,这使得它们能够与更广的APC谱[spectrum]形成有效的相互作用。遭遇刺激时,记忆T细胞也要比naive T细胞更敏感,响应更快。这些特性可能是由于它们能够更容易[readily]地调节基因表达。而这种调节能力或许是由于它们在形成过程中产生的表观遗传组织[epigenetic organization]。最后,记忆T细胞和naive T细胞或效应T细胞的区别在于它的再循环模式。一些在淋巴结和其他次级淋巴器官中存在很长的时期,另外一些则循环到感染起始的外周免疫组织并驻留在此,并在同种抗原再次侵袭时发挥作用。
随着我们识别不同细胞表面蛋白能力的提升,我们已经可以区分和分离记忆细胞的不同亚群了。依据它们所在的位置、表面标记分子[marker]并在某种程度上参考功能,目前将记忆T细胞宽泛地分为两个亚群:中心记忆T细胞[central memory T cells|T**CM**]和效应记忆T细胞[effector memory T cells|T**EM**]。近期的研究提示这些亚群之间存在很大的差异,它们之间的关系也仍在研究中。下面是一些有用的概括,并列出了仍存在的问题。
初始、效应、记忆T细胞在表面蛋白表达上存在广泛的差异
三个表面marker广泛用于区分初始、效应和记忆T细胞:CD44(激活信号激发后增强表达)、CD62L(一种黏附蛋白)、CCR7(一种驱化因子受体)。CD62L和CCR7都参与到了向次级淋巴器官迁移的过程中。Naive T细胞表达低水平的CD44,说明它处在未激活的状态。Naive T细胞同时表达高水平的黏附分子CD62L,引导它们向淋巴结或脾脏迁移。而效应辅助T细胞和T细胞有着相反的表型。它们表达高水平的CD44,提示已经接收到了TCR信号;同时表达低水平的CD62L,让它们彻底地探索[probe]外周的感染部位,而非再循环到次级淋巴组织。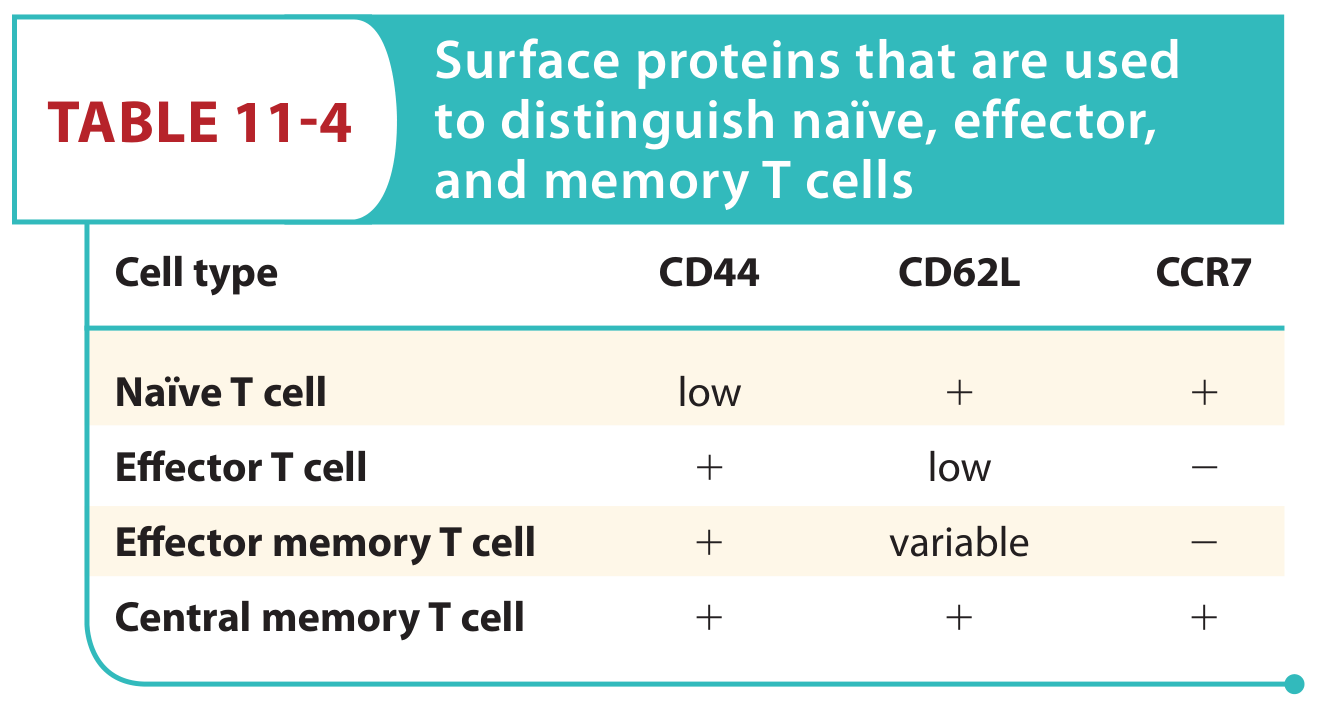
两种记忆T细胞也趋向于表达CD44,提示它们是经历过抗原刺激的[antigen experienced]。与naive T细胞相似,T表达CD62L和CCR7,这与它们在次级淋巴器官中的驻留是一致的。在多种组织中都存在的T视所在部位的不同,表达不同水平的CD62L。但是T不表达CCR7,这反映出它们穿过并驻留在非淋巴组织中。利用另外一些marker也能够区分记忆细胞的亚群,但是这三个marker仍为探究T细胞的状态提供了有用的初始手段。
Tcm和Tem在位置和效应功能上相区别
收到抗原刺激后并大量增殖后,naive T细胞中的一小群(<10%)分化为T和T细胞。总的来说,这两个亚群可以藉由他们存在的位置以及向特定效应细胞分化的能力区分。
T通常存在和游荡于次级淋巴组织中。和T相比,它们更长寿且有更强的分裂潜能。当它们在次级淋巴器官中再次遭遇同源病原体时,能被迅速激活并视所处的细胞因子环境分化为多样的效应T细胞。
另一方面,T存在和游荡于外周组织(包括皮肤、肺、肝和肠)之间。由于TEM已经是趋向效应细胞分化的细胞系了,因此照理说更适合应对再次感染的第一线。当受到同一病原体侵入时,它们也能更快的发挥效应作用。
需要说明的是,这些总结中的一部分或许还没有一致的科学评议。例如,一些研究者对TCM和TEM确定的[definitive]差异以及这些亚群之间的区别和联系还在争论。记忆细胞生物是及其活跃的研究领域,因为这个领域的研究对疫苗的研发至关重要。
记忆发生的时间和方式是怎样的?
近期的研究表明,在免疫反应的早期(例如,3天以内)记忆细胞就已经产生了。但是这些记忆细胞的来源仍存在争议。一些研究者认为,当naive T细胞激活之后,记忆细胞就产生了;另一些则认为记忆细胞的来源是完全分化了的naive T细胞。此外,还有些研究者提出了奇妙[intriguing]的假设:naive T细胞激活之后会产生一种“记忆干细胞[memory stem cell]”。这些细胞能够自我更新同时也能形成记忆效应细胞。当然并不仅只有这些推断,也有可能记忆细胞的形成存在于初始反应中T细胞激活的各个阶段。
T和T的关系也有争议。它们可能独立地来自naive和效应T细胞,或者可能彼此转化。事实上有研究提示T细胞来自于T。下面是一个可能的模型。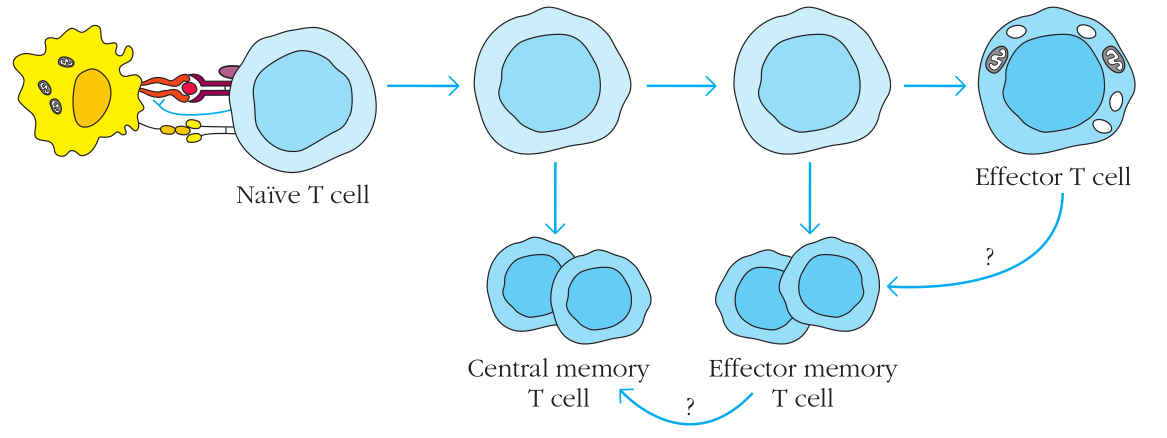
Figure 11-13 中心和效应记忆细胞发生发展一个可能的模型
在这个模型中,研究者推测T的发生早于T。来自还未分化为效应细胞的T细胞。T在其后产生,也可能从完全分化的效应细胞而来。这个模型同时提示效应细胞可以补充[replenish]中心记忆细胞。
然而,需要强调的是,另外也有提出其他几种模型。例如,近期的工作提示,效应细胞间的相互作用决定了它们向T还是T分化。和B细胞相互作用的效应T细胞或许更倾向于分化为T而非T。新的模型或许也需要将一些近期发现的有趣现象考虑在内,包括:①记忆细胞来自于激活T细胞的非对称分裂,其中一个分化为效应细胞,而另一个加入了记忆细胞池[contributes to memory pool];②T细胞激活产生了可以自我更新的记忆干细胞群,它们可以为记忆细胞提供持久的来源。
哪些细胞信号介导了细胞记忆的形成[commitment]?
大多数研究者同意这种观点:辅助T细胞对产生长期记忆[long-lasting memory]的产生是不可或缺的。例如,CD8T细胞可以在缺失CD4辅助T细胞的情况下被激活,但将不能产生CD8+长寿记忆T细胞。其他在记忆形成中的重要因素仍在研究中。尽管T细胞受体的参与是影响记忆细胞分化的因素,近期的数据表明即使低亲和力的相互作用也能产生记忆T细胞。然而,所有的研究都表明,免疫反应中增殖越多,会产生更好的记忆池[memory pool]。
记忆细胞反映了抗原初次刺激时效应细胞的异质性吗?
我们已经明了naive T细胞广泛地根据它们在激活过程中的细胞因子信号,分化为多种多样的效应T细胞亚群。研究提示,由于T细胞受体特异性和细胞因子序列[array]的缘故,记忆细胞反应也十分广泛。然而,这种多样性的胞内机制仍在研究中。特别要考虑的是,这种记忆反应的多样性是否严格对应了在初始反应中的功能多样性?或者有其他可能:在再次遭遇病原体时,根据不同的环境线索[cues],多样性是由中心记忆T细胞反应产生的?最终的答案似乎是“两者都是”,但是相关的研究还在继续。
CD4和CD8记忆T细胞有差异吗?
简单回答的话,是“或许有差异”。CD8记忆T细胞明显要比CD4记忆T细胞的存在更广泛。部分原因在于CD8T细胞增殖更强力因而能产生更多的记忆T细胞。这两种记忆细胞在寿命上也有差异:CD4T细胞或许比CD8T细胞更短寿。
记忆细胞为什么能长期存在?
尽管有一些证据支持,但是当病原体缺失时,记忆细胞是否能长期存在(years)仍存在争议。不管怎样,记忆的持续似乎依赖于介导偶然分裂[occasional divisions]的细胞因子。这个过程被称为静态增殖[homeostatic proliferation]。通过平衡凋亡和分裂活动,记忆池的规模得以稳定。IL-7和IL-15对增强静态增殖都很重要。但是CD4T细胞和CD8T细胞达到静态增殖的需求或许是有区别的。
小结
- T细胞激活是适应性免疫启动的核心事件。T细胞的激活来自在次级淋巴器官中naive T细胞和APC,明确的说是naive T细胞和树突状细胞的相互作用。
- naive T细胞的激活引发了效应T细胞的分化和长寿记忆细胞[long-lived memory cells]的形成。其中,效应T细胞可以调节对病原体的免疫反应,长寿记忆细胞可以更快更强地响应同一病原体。
- 要启动T细胞的激活、增殖和分化,需要三种不同的信号。第一信号由T细胞的TCR-CD3复合物和树突状细胞上的MHC-病原蛋白复合物相互作用提供;第二信号由T细胞上的正向共刺激分子如CD28或者ICOS和APC上的B7家族之间的相互作用提供;第三信号由可溶性[soluble]细胞因子提供。第三信号也是决定T细胞分化为哪种效应细胞的决定性因素。
- 共刺激信号(第二信号)的缺失会导致T细胞无功能[inactivity]或者克隆失能[clonal anergy]。
- 基本上体内所有的细胞都会表达MHCⅠ类分子。CD8T细胞可以识别MHCⅠ类分子-蛋白复合物,并在激活后获得杀伤被感染细胞的能力。
- MHCⅡ类分子由专职APC[professional APC]表达。CD4T细胞可以识别MHCⅡ类分子-蛋白复合物,并在激活后分化为可以分泌细胞因子的辅助T细胞[T细胞]。TH细胞有调节B细胞、巨噬细胞和其他T细胞功能的能力。
- CD4+T细胞可以分化为至少5类效应细胞:T1,T2,T17,iTT。每个亚群都有:1. 一类独特的分化细胞因子[polarizing cytokines]启动分化的开始;2. 一种起主导作用的转录因子[transcriptional factor]调控辅助相关的基因表达;3. 一类独特的效应分子,可以调控免疫反应。
- T1和T17通常能够增强细胞介导的免疫和炎症反应。T2和T细胞能增强体液免疫和抗体产生,同时介导T细胞抑制T细胞反应。
- 辅助T细胞亚群和疾病相关,在自身免疫疾病和过敏性疾病中起到一定作用。
- 记忆T细胞比naive细胞更容易激活。记忆T细胞负责二次免疫反应。
- B细胞、CD4+T细胞和CD8+T细胞免疫记忆的形成都需要T细胞的辅助。
- 目前已有两种类型的记忆T细胞被发现[described]。中心记忆细胞[Central memory|TCM]细胞是长寿的,位于次级淋巴组织中,可以分化为数种效应T细胞。效应记忆细胞[Effector memory|TEM]则位于感染发生区域(三级组织[tertiary tissues]),可以在遇到同种病原体时快速响应,发挥效应功能。

