FDA黑框警告
1.血液学毒性
4.诱变和致癌作用
1.【药理作用】
- 更昔洛韦是一种鸟嘌呤核苷酸的类似物,在体外和体内均可抑制巨细胞病毒(CMV)复制。
- 本品主要以原型通过肾脏排出,肝损伤预期不会影响更昔洛韦的药代动力学
- 尚未研究赛美维在肝损伤患者中的安全性和疗效。
2.【适应症】
- 治疗危及生命或视觉的免疫缺陷患者的巨细胞病毒感染,
- 预防器官移植病人的巨细胞病毒感染。
3.【用法用量】
1. 用以治疗巨细胞病毒感染的标准剂量
1.诱导治疗:剂量为 5 mg/kg,q12h,疗程 14~21 天。
2.维持治疗:剂量为 5 mg/kg,qd,每周 7 次,或 6 mg/kg, 每天一次,每周 5 次。
2. 预防器官移植病人巨细胞病毒感染的标准剂量
- 诱导治疗: 5 mg/kg,q12h,疗程 7~14 天。
- 维持治疗: 5 mg/kg,qd,每周 7 次;或 6 mg/kg,每天一次,每周 5 次。
3.肾脏损害患者: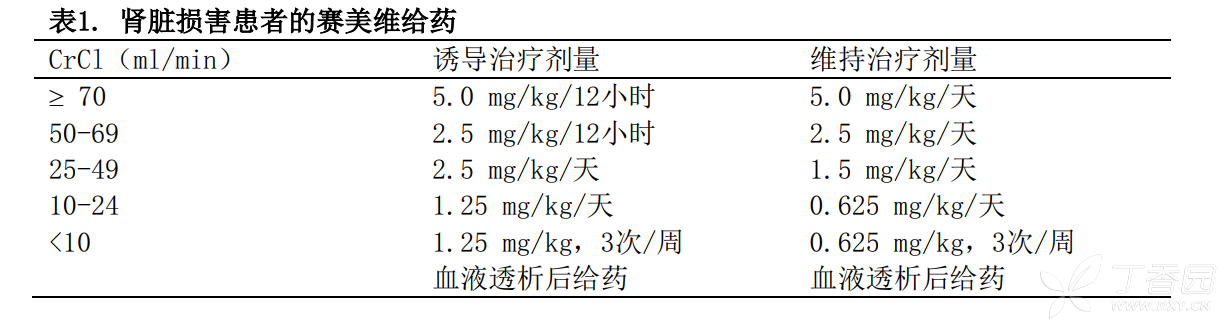
4. 使用、 处理及处置特别说明
- 赛美维只能通过静脉输注给药,时间必须超过 1 小时(pH 11)。不得通过快速静脉输注或推注给药,因为血浆水平过高可能增加赛美维的毒性。
- 赛美维是人体潜在的致畸剂和致癌物。避免吸入或直接接触药瓶内的粉末或复溶溶液。建议复溶期间,戴一次性手套。
- 本品的配制方法:首先根据体重确定使用剂量,用适量注射用水或氯化钠注射液将之溶解,浓度达 50 mg/ml,再加入到氯化钠注射液或 5% 葡萄糖注射液、复方氯化钠注射液、复方乳酸钠注射液 100 ml 静脉滴注,滴注浓度不能超过 10 mg/ml。
4.【不良反应】
1.最严重和最常见的药物不良反应是血液学反应,包括中性粒细胞减少症、贫血和血小板减少症。
2.如果绝对中性粒细胞计数小于 500/µL,或者血小板计数小于 25*10^3/µL,或者血红蛋白小于 8 g/dL,不应用药。
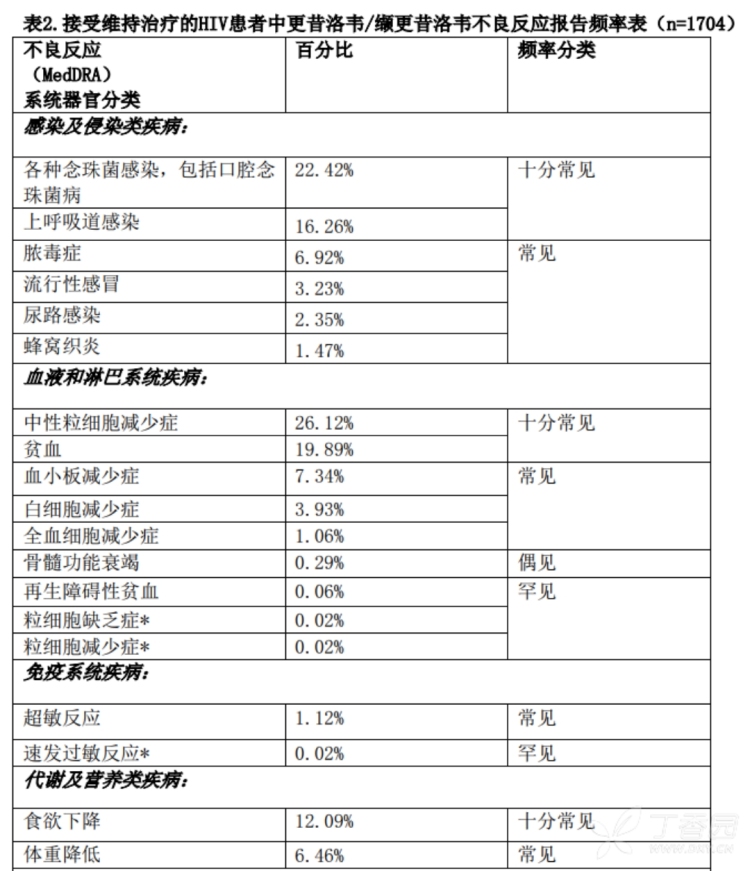
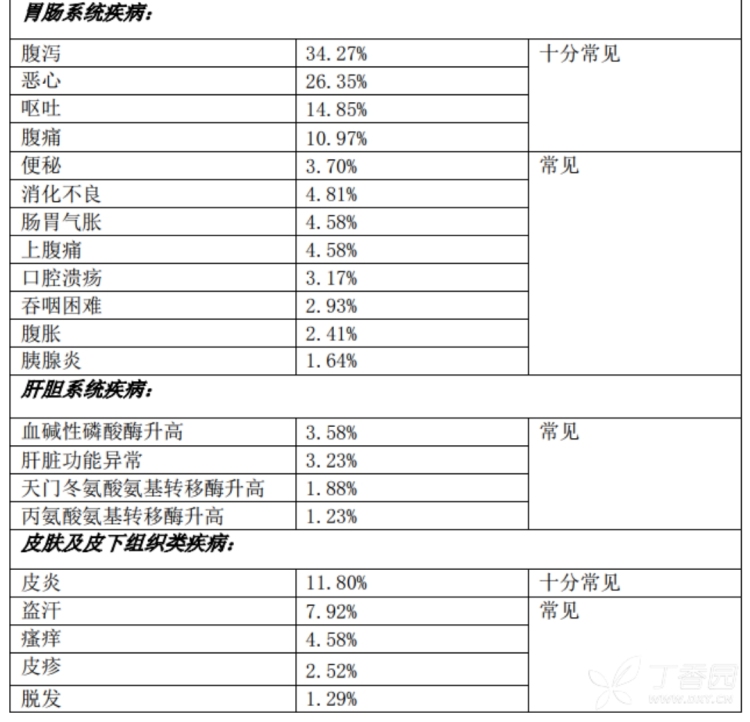
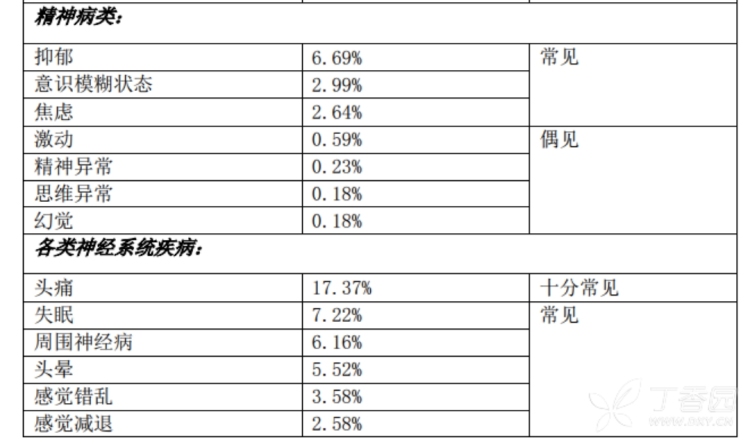
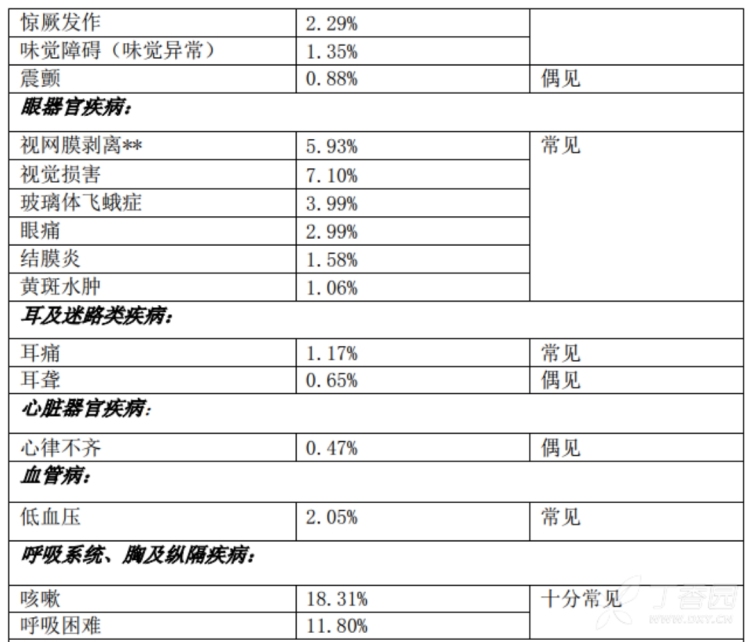
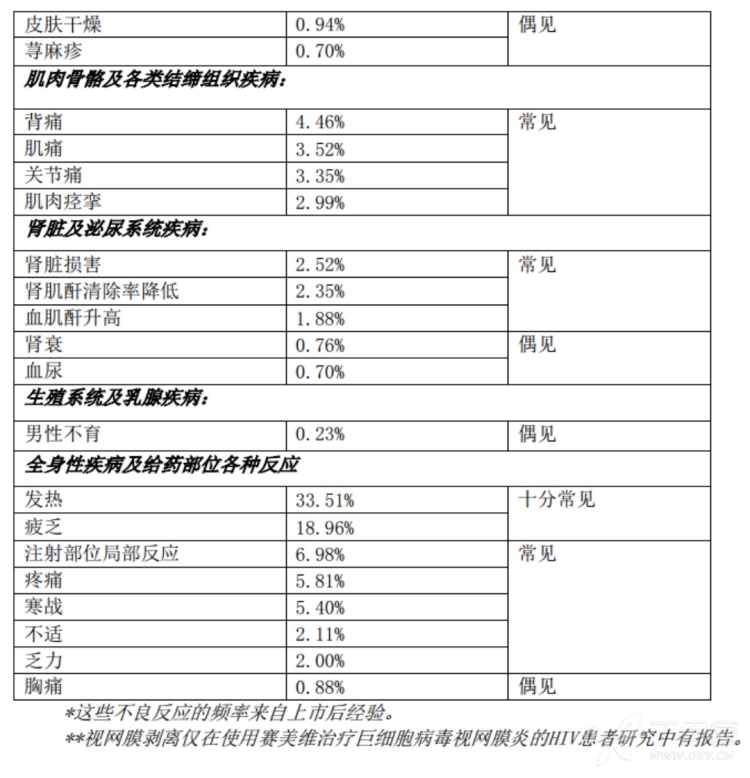
3.频率大于10%的不良反应(均为上市后报告,需要考虑原发病影响):念珠菌感染,上感,骨髓抑制,腹泻,恶心,呕吐,腹痛,皮炎,头痛,咳嗽,呼吸困难,发热,疲乏。
4.肝肾功能异常约2%。
5.药物相互作用:
- 亚胺培南-西司他丁:有报告称,患者同时接受更昔洛韦和亚胺培南-西司他丁治疗发生抽搐。除非潜在的益处大于风险,否则这些药品不应当联合使用。
- 更昔洛韦与其他已知有骨髓抑制作用或引起肾脏损害的药物合用时,毒性可能增强。包括核苷类似物(例如齐多夫定、去羟肌苷、司他夫定)、免疫抑制剂(例如环孢素、他克莫司、吗替麦考酚酯)、抗肿瘤药物(例如多柔比星、长春新碱、长春碱、羟基脲)、和抗感染药物(例如甲氧苄啶/磺胺类药、氨苯砜、两性霉素 B、氟胞嘧啶、喷他脒)。因此这些药物应当仅在潜在获益超过风险时才考虑与更昔洛韦合用。
6.【注意事项】
1.交叉过敏:
由于更昔洛韦的化学结构与阿昔洛韦和喷昔洛韦,伐昔洛韦相似,这些药物间可能存在交叉过敏反应。
2.致突变、致畸性、致癌性、生育力损害
- 动物研究中发现更昔洛韦具有致突变、致畸、致癌作用并损害生育力。
- 建议具有生育潜能的女性患者在使用注射用更昔洛韦治疗期间及之后至少30 d内采取有效的避孕措施。建议男性患者在用药后90 d内采取屏障避孕。
3.老年用药
由于肾脏清除率随着年龄的增长而降低,因此对老年患者使用更昔洛韦时应特别考虑其肾脏状况。需监测肾功能并相应调整剂量。
4.儿童用药
由于潜在致癌性和生殖毒性,儿科人群使用本品应特别谨慎,仅在仔细评价且利大于弊时方可用药。
儿童接受本品治疗,不良事件与成人相似。

