左氧氟沙星
左氧氟沙星
编辑时间:2002
修改时间:2021-04-07
【特别警示】
1.氟喹诺酮类药(包括本药)可致残,并可能引起不可逆的严重不良反应(包括肌腱炎、肌腱断裂、周围神经病变及中枢神经系统不良反应)。若出现以上不良反应,应立即停药,并避免再次使用此类药物。(国内药品说明书-盐酸左氧氟沙星片)
2.氟喹诺酮类药(包括本药)可能加剧重症肌无力患者的肌无力症状,故有重症肌无力病史者应避免使用本药。(国内药品说明书-盐酸左氧氟沙星片)
3.鉴于氟喹诺酮类药(包括本药)可能引起严重不良反应,且对部分患者,急性细菌性鼻窦炎、慢性支气管炎急性发作、单纯性尿路感染、急性非复杂性膀胱炎有自限性,上述疾病患者仅在无其他药物治疗时方可使用本药。(国内药品说明书-盐酸左氧氟沙星片)
【药物名称】
中文通用名称:左氧氟沙星
英文通用名称:Levofloxacin
其他名称:爱信(左氧氟沙星)、可乐必妥(左氧氟沙星)、莱沃莘、立佳、廉素、名力爽、瑞科沙(左氧氟沙星)、妥必速、西普克定、左
氟沙星、左福康、左利欣、左旋氧氟沙星、Cravit、Iquix、Levaquin、Levofloxacinum、Quinsair、Quixin。
【药理分类】
西药 \ 皮肤及皮下用药 \ 皮肤抗感染药 \ 皮肤抗细菌药
西药 \ 耳鼻喉科用药
西药 \ 眼科用药 \ 眼用抗菌药
西药 \ 抗感染药 \ 合成抗菌药 \ 喹诺酮类
【临床应用】 国内批准适应症
1.本药口服和注射制剂用于治疗敏感菌引起的下列轻、中、重度感染:
(1)医院获得性肺炎、社区获得性肺炎、急性细菌性鼻窦炎、慢性支气管炎急性细菌性发作。
(2)非复杂性皮肤及皮肤结构感染(包括脓肿、蜂窝织炎、疖、脓疱病、脓皮病、伤口感染)、复杂性皮肤及皮肤结构感染。
(3)慢性细菌性前列腺炎、复杂性尿路感染、非复杂性尿路感染、急性肾盂肾炎。
(4)吸入性炭疽(暴露后)。
2.本药眼用制剂用于治疗敏感菌引起的眼睑炎、睑腺炎、泪囊炎、结膜炎、睑板腺炎、角膜炎、角膜溃疡及预防眼科围手术期感染。
3.本药滴耳液用于治疗敏感菌引起的外耳道炎、中耳炎。
4.本药乳膏用于治疗敏感菌引起的化脓性皮肤病(如脓疱疮、疥疮、毛囊炎)。
【用法与用量】 国内批准用法用量
·常规剂量
·医院获得性肺炎
1.口服给药
一次750mg,每24小时1次,疗程为7-14日。应根据需要采取其他辅助治疗措施,如证明或疑似为铜绿假单胞菌感染,建议与抗假单胞菌的β-内酰胺类药联用。
2.静脉滴注
·社区获得性肺炎
1.口服给药
(1)5日治疗方案:
用于由肺炎链球菌(包括多重耐药性菌株)、流感嗜血杆菌、副流感嗜血杆菌、肺炎支原体或肺炎衣原体引起的社区获得性肺炎,一次750mg,每24小时1次,疗程为5日。
(2)7-14日治疗方案:
用于由甲氧西林敏感性金黄色葡萄球菌、 肺炎链球菌(包括多重耐药性菌株)、流感嗜血杆菌、副流感嗜血杆菌、肺炎克雷伯杆菌、卡他莫拉菌、肺炎衣原体、肺炎军团菌或肺炎支原体引起的社区获得性肺炎,一次500mg,每24小时1次,疗程为7-14日。
2.静脉滴注 参见“口服给药”项。
·急性细菌性鼻窦炎
1.口服给药
(1)5日治疗方案:一次750mg,每24小时1次,疗程为5日。
(2)10-14日治疗方案:一次500mg,每24小时1次,疗程 为10-14日。
2.静脉滴注 参见“口服给药”项。
·慢性支气管炎急性细菌性发作
1.口服给药 一次500mg,每24小时1次,疗程为7日。
2.静脉滴注 参见“口服给药”项。
·非复杂性皮肤及皮肤软组织感染
1.口服给药 一次500mg,每24小时1次,疗程为7-10日。
2.静脉滴注 参见“口服给药”项。
3.局部给药 (1)用于脓疱疮:涂檫于患处,一日3次,疗程为5日。(2)用于其他化脓性皮肤病:涂檫于患处,一日1次,疗程为7日。
·复杂性皮肤及皮肤软组织感染
1.口服给药 一次750mg,每24小时1次,疗程为7-14日。
2.静脉滴注 参见“口服给药”项。
·慢性细菌性前列腺炎
1.口服给药 一次500mg,每24小时1次,疗程为28日。
2.静脉滴注 参见“口服给药”项。
·复杂性尿路感染、急性肾盂肾炎
1.口服给药
(1)5日治疗方案:用于由大肠埃希菌、肺炎克雷伯杆菌、奇异变形杆菌引起的复杂性尿路感染或由大肠埃希菌引起的急性肾盂肾炎(包括伴菌血症者),一次750mg,每24小时1次,疗程为5日。
(2)10日治疗方案:用于由粪肠球菌、阴沟肠杆菌、大肠埃希菌、肺炎克雷伯杆菌、奇异变形杆菌、铜绿假单胞菌引起的复杂性尿路感染或由大肠埃希菌引起的急性肾盂肾炎(包括伴菌血症者),一次250mg,每24小时1次,疗程为10日。
2.静脉滴注 参见“口服给药”项。
·非复杂性尿路感染
1.口服给药 一次250mg,每24小时1次,疗程为3日。
2.静脉滴注 参见“口服给药”项。
·吸入性炭疽(暴露后)
1.口服给药 一次500mg,每24小时1次,疗程为60日。于疑似或明确暴露后尽快用药。因成人使用本药超过28日的安全性尚不明确,故仅在利大于弊时方可长期用药。
2.静脉滴注 参见“口服给药”项。
·眼睑炎、睑腺炎、泪囊炎、结膜炎、睑板腺炎、角膜炎、角膜溃疡、预防眼科围手术期感染
1.经眼给药
(1)滴眼液:
①0.3%的浓度:一次1-2滴,一日3-5次,细菌性结膜炎疗程为7日,细菌性角膜炎疗程为9-14日。
②0.48 8%的浓度:一次1滴,一日3次,根据症状可适当增减剂量。角膜炎急性期每15-30分钟滴眼1次,严重者最初30分钟内每5分钟滴1次,病情控制后逐渐减少滴眼次数。
(2)眼用凝胶:涂于眼下睑穹隆处,一日3次(早、中、晚各1次)。
·外耳道炎、中耳炎
1.经耳给药 滴耳液:一次6-10滴,一日2-3次,滴耳后进行约10分钟的耳浴。根据症状适当增减滴耳次数,疗程不超过4周,4周后继续给药应谨慎。
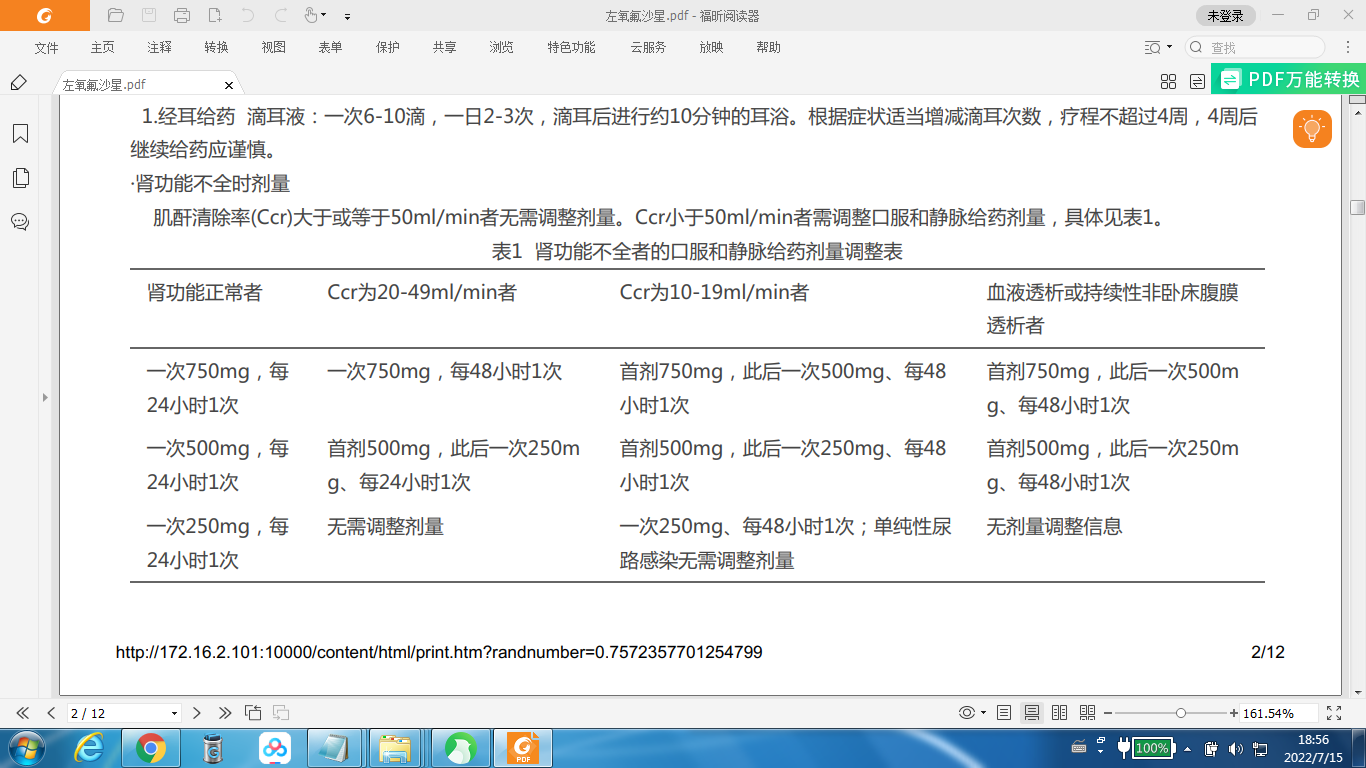
·肾功能不全时剂量
·老年人剂量 老年人无需调整剂量。
儿童
·常规剂量
·吸入性炭疽(暴露后)
1.口服给药 6个月及6个月以上儿童:体重低于50kg者,一次8mg/kg(不超过250mg),每12小时1次,疗程为60日;体重高于50k
g者,用法用量同成人。于疑似或明确暴露后尽快用药。因儿童使用本药超过14日的安全性尚不明确,故仅在利大于弊时方可长期用
药。
2.静脉滴注 参见“口服给药”项。
其他用法用量参考
·常规剂量
·预防和治疗鼠疫(包括肺炎型鼠疫和败血型鼠疫)
1.口服给药 一次500mg,每24小时1次,疗程为10-14日。
2.静脉滴注 一次500mg,每24小时1次,疗程为10-14日。
·防治因动物或人咬伤引起的感染的替代疗法
1.口服给药 一次750mg,一日1次,与抗厌氧菌药物联用。治疗的疗程为5-14日,预防的疗程为3-5日。
2.静脉滴注 参见“口服给药”项。
·非复杂性旅行性腹泻的经验治疗
·耐药性结核病的替代治疗
1.口服给药 (1)一次750-1000mg,每24小时1次。与抗结核药物联用。(2)异烟肼耐药结核病:一日500-750mg,疗程为6个月。(3)
耐多药结核病、利福平耐药结核病:体重为30-45kg者,一次750mg,一日1次;体重大于45kg者,一次1000mg,一日1次;肌酐
清除率小于30ml/min者,一次750-1000mg,一周3次,不可每日服用。疗程为9-24个月。
2.静脉滴注 参见“口服给药”项。
·轻至中度盆腔炎性疾病的替代治疗
1.口服给药 一次500mg,一日1次,疗程为14日,与或不与甲硝唑联用。
·药物敏感性结核病的替代治疗
1.口服给药 (1)一次500-1000mg,每24小时1次,与抗结核药物联用。(2)初治肺结核:一日500-750mg,疗程通常为6个月。复
治肺结核:一日500-750mg,疗程通常为8个月,肺外结核疗程应适当延长。
2.静脉给药 参见“口服给药”项。
·预防化学治疗诱导的中性粒细胞减少者的细菌感染
1.口服给药 一次500mg或750mg,一日1次。对造血细胞移植的患者,从接受干细胞开始持续用药直至中性粒细胞恢复或开始进行
中性粒细胞减少性发热的经验性抗菌治疗。
·预防围手术期感染
1.静脉给药 于手术切开前2小时给予本药500mg。
·会阴或腋窝处手术部位的感染
1.口服给药 一次750mg,每24小时1次,与甲硝唑联用。
·耐药、重症及难治性结核性脑膜炎
1.口服给药 一次20mg/kg,一日1次,疗程为3-6个月。
2.静脉滴注 参见“口服给药”项。
·由肠道微生物引起的急性附睾炎或进行肛交的男性患者由性传播衣原体、淋球菌和肠道微生物引起的急性附睾炎
1.口服给药 (1)由肠道微生物引起的急性附睾炎:一次500mg,一日1次,疗程为10日。(2)进行肛交的男性患者由性传播衣原体、
淋球菌和肠道微生物引起的急性附睾炎:一次500mg,一日1次,疗程为10日,与头孢曲松联用。
·防治眼球贯通伤引起的感染
1.口服给药 一次500mg,一日1次,同时局部加用左氧氟沙星滴眼液。应持续用药1周或经全面评估后停药。
2.静脉滴注 参见“口服给药”项。
·根除幽门螺杆菌(Hp)的四联方案
1.口服给药 本药一次500mg,一日1次或一次200mg,一日2次,餐后服用;联用阿莫西林(一次1000mg,一日2次,餐后服用)、标准剂量的质子泵抑制药(PPI)和铋剂(一日2次,餐前0.5小时服用)。但该方案不作为初次治疗方案。
·泌尿生殖道支原体感染
1.口服给药 一次500mg,一日1次,连用7日。
儿童
·常规剂量
·预防和治疗鼠疫(包括肺炎型鼠疫和败血型鼠疫)
1.口服给药 6个月及6个月以上儿童:体重低于50kg者,一次8mg/kg(不超过250mg),每12小时1次,疗程为10-14日;体重高于5
0kg者用法用量同成人。
2.静脉滴注 参见“口服给药”项。
·耐药性结核病的替代治疗
1.口服给药 小于或等于5岁的儿童,一日15-20mg/kg,一日2次(早晚各一次)。大于5岁的儿童,一日10-15mg/kg,一日1次。疗
程为9-24个月。
2.静脉滴注 参见“口服给药”项。
·药物敏感性结核病的替代治疗
1.口服给药 小于或等于5岁的儿童,一日15-20mg/kg,一日2次(早晚各一次)。大于5岁的儿童,一日10-15mg/kg,一日1次。初
治和复治敏感肺结核疗程分别为6个月和8个月,肺外结核疗程应适当延长。
·预防围手术期感染
1.术前给予10mg/kg。
·耐药、重症及难治性结核性脑膜炎
1.口服给药 12岁及12岁以上儿童,一次20mg/kg,一日1次,疗程为3-6个月。
2.静脉滴注 参见“口服给药”项。
·儿童社区获得性肺炎
1.口服给药 (1)6个月-5岁儿童:一次8-10mg/kg,每12小时1次,最大日剂量为750mg。疗程为10日。(2)5-16岁儿童:一次8-10
mg/kg,一日1次。疗程为10日。(3)骨骼成熟的青少年:一次500mg,一日1次。疗程为10日。
2.静脉滴注 参见“口服给药”项。
·儿童急性细菌性鼻窦炎
1.口服给药 一日10-20mg/kg,分为每12-24小时1次,疗程为10-14日。
·儿童角膜溃疡
1.经眼给药 6岁及6岁以上儿童,1.5%滴眼液,第1-3日,一次1-2滴,每0.5-2小时1次(非睡眠期间);一次1-2滴,每4-6小时1次
(睡眠期间)。第4日至治疗结束,一次1-2滴,每1-4小时1次(非睡眠期间)。
·儿童细菌性结膜炎
1.FDA推荐剂量 经眼给药:6岁及6岁以上儿童,0.5%滴眼液,第1-2日,一次1-2滴,每2小时1次(非睡眠期间,一日最多8次)。第
3-7日,一次1-2滴,每4小时1次(非睡眠期间,一日最多4次)。
2.EMA推荐剂量 经眼给药:1岁及1岁以上儿童,同上。
【给药说明】
给药方式说明
1.口服给药 使用本药口服制剂时可不考虑进食的影响,建议在进食前1小时或进食后2小时服用。
2.静脉滴注 本药注射剂剂量为250mg或500mg时,滴注时间不少于60分钟;剂量为750mg时,滴注时间不少于90分钟。滴速过快或静脉注射可能导致低血压,应避免。
3.经眼给药 本药滴眼液仅用于滴眼,不可用于结膜下注射,也不可直接滴入眼前房内。
4.经耳给药 本药滴耳液使用时药温过低可能引起眩晕,故使用温度应接近体温。
5.其他 本药注射剂不可经肌内、鞘内、腹膜内或皮下给药。
注射液的配制
静脉滴注液:
(1)本药粉针剂、小容量注射液应用适当溶液稀释至5mg/ml。(2)稀释后,在25℃及低于25℃条件下可保存72小时,
在5℃条件下可保存14日,-20℃条件下可保存6个月。(3)静脉滴注液冷冻后可置于25℃或8℃条件下融解,勿用微波或水浴加速其融解,融解后不能再次冻融。
【禁忌症】
1.对喹诺酮类药过敏者。
2.皮肤有药物过敏史者禁用本药乳膏。
3. 18岁以下儿童禁用本药全身制剂(除用于吸入性炭疽外)。
4.妊娠期妇女或可能妊娠的妇女禁用本药全身制剂。
5.哺乳期妇女禁用本药全身制剂。
【慎用】
【特殊人群】
儿童
在未成年动物中使用本药可致关节病变、骨或软骨病变,故国内资料建议18岁以下儿童禁用本药全身制剂(除用于吸入性炭疽外)。
儿童的剂量信息参见“用法与用量”项。
老人
1.65岁及65岁以上老人与年轻者使用本药的有效性无明显差异,但老人用药可增加发生肌腱炎、肌腱断裂的风险,故老人应慎用本药全身制剂,尤其是与糖皮质激素合用时。老人的剂量信息参见“用法与用量”项。
2.流行病学研究表明,使用氟喹诺酮类药后2个月内主动脉瘤、主动脉夹层的发生率升高,尤其是老人。
特殊疾病状态
1.重症肌无力或有重症肌无力病史者:氟喹诺酮类药(包括本药)可能加剧重症肌无力患者的肌无力症状,故此类患者应避免使用本药。
2.有肌腱疾病病史、曾发生肌腱炎或肌腱断裂的患者:上述患者应避免使用氟喹诺酮类药。
3.QT间期延长、未纠正的低钾血症患者:本药可延长QT间期,上述患者应避免使用。
4.已知或疑似中枢神经系统疾病(如严重的脑动脉硬化、癫痫)或有其他风险因素(如有发作倾向或发作阈值降低)的患者:此类患者仅在利大于弊的情况下方可使用本药。
5.有周围神经病变病史者:此类患者应避免使用氟喹诺酮类药。
6.接受肾脏、心脏或肺移植的患者:此类患者使用本药可增加发生肌腱炎和肌腱断裂的风险。
7.主动脉瘤或有主动脉瘤高风险的患者:上述患者仅在无其他抗菌治疗方案可用时方可使用本药。
【不良反应】
1.心血管系统 主动脉瘤、主动脉夹层、心搏骤停、心悸、室性心律失常(如室性心动过速)、血管炎(如静脉炎)、QT间期延长。上市后
还有心动过速、血管舒张的报道。
2.代谢/内分泌系统 高血糖症、低血糖症、高钾血症。
3.呼吸系 统 呼吸困难、鼻出血。上市后还有嗅觉丧失、嗅觉异常的报道。
4.肌肉骨骼系统 关节痛、肌痛、骨痛、肌无力、张力亢进、肌腱炎、肌腱断裂、重症肌无力恶化。上市后还有肌损伤、横纹肌溶解、
肌酶升高的报道。
5.泌尿生殖系统 阴道炎、肾功能异常(如急性肾功能不全)、肾衰竭。上市后还有间质性肾炎的报道。
6.免疫系统 超敏反应[荨麻疹、瘙痒、严重皮肤反应(如中毒性表皮坏死松解症、多形性红斑)、呼吸困难、血管神经性水肿(包括舌、
喉、咽或面部水肿或肿胀)、心血管性虚脱、低血压、意识丧失、气道阻塞(包括支气管痉挛、气促、急性呼吸窘迫)、过敏性肺炎、过
敏性休克]、血清病。
7.神经系统 头晕、头痛、意识模糊、睡眠障碍(如失眠、嗜睡)、震颤、惊厥、感觉异常、眩晕、运动过度、步态异常、晕厥、癫痫发
作、周围神经病变(感觉错乱、感觉迟钝、触物痛感、疼痛、烧灼感、麻刺感、麻木、无力,轻触觉、痛觉、温度觉、位置觉和振动觉
异常,多发性神经炎)、颅内压升高(包括假性脑瘤)。上市后还有脑病、脑电图(EEG)异常、发声困难的报道。
8.精神 焦虑、激动、抑郁、幻觉、梦魇、梦境异常、中毒性精神病、躁动、妄想、抑郁、自杀意念、自杀行为。上市后还有偏执狂、
自杀未遂的报道。
9.肝脏 肝酶(包括碱性磷酸酶)升高、肝炎、黄疸、急性肝坏死、肝衰竭。
10.胃肠道 恶心、呕吐、腹泻[包括艰难梭菌相关性腹泻(CDAD)]、便秘、腹痛、消化不良、厌食、口炎(如舌炎)、胰腺炎、食管炎、
胃肠炎(如胃炎、假膜性结肠炎)。上市后还有味觉丧失、味觉障碍的报道。
11.血液 贫血、血小板减少、粒细胞减少。上市后还有全血细胞减少、白细胞减少、嗜酸粒细胞增多、凝血酶原时间延长、国际标准
化比值(INR)升高的报道。
12.皮肤 皮疹、瘙痒、荨麻疹。上市后还有Stevens-Johnson综合征、中毒性表皮坏死松解症、急性泛发性发疹性脓疱病(AGEP)、固
定性药疹、多形性红斑、光敏反应、光毒性、白细胞破碎性血管炎的报道。
13.眼 (1)白内障、晶状体点状混浊,但与本药的相关性尚不明确。上市后还有葡萄膜炎、视觉障碍(包括复视)、视力下降、视物模
糊、暗点的报道。(2)经眼给药:眼部刺激、角膜疾病(如弥漫性表层角膜炎)、眼睑炎(包括眼睑发红、眼睑水肿)、眼睑皮肤炎、眼部
瘙痒、结膜炎(包括结膜充血、结膜水肿)、眼痛、一过性眼灼热、畏光、眼干。
14.耳 (1)上市后有听力减退、耳鸣的报道。(2)经耳给药:中耳痛、瘙痒。
15.其他 念珠菌病(如生殖器念珠菌病)、水肿、静脉滴注部位反应、胸痛。上市后还有多器官衰竭、发热的报道。
【药物相互作用】
药物-药物相互作用
1.皮质类固醇:
结果:合用可增加发生肌腱炎和肌腱断裂的风险。
2.非甾体类抗炎药:
结果:合用可增加发生中枢神经系统刺激和癫痫发作的风险。
3.丙磺舒、西咪替丁:
结果:在健康受试者中进行的临床试验表明,以上药物对本药的吸收速率和吸收程度无明显影响。但以上药物与本药合用可使本药的
曲线下面积(AUC)增加、全身总清除率(CL/F)降低、肾清除率(CLR)降低、半衰期(t1/2)延长。
处理:合用时无需调整剂量。
4.环孢素:
结果:在健康受试者中进行的临床试验表明,本药对环孢素的血药峰浓度(Cmax)、AUC和其他代谢参数无明显影响。但有患者合用环
孢素和其他氟喹诺酮类药导致环孢素血浆浓度升高的报道。此外,环孢素可使本药的Cmax和消除速率常数(Ke)轻微降低、达峰时间
(tmax)和t1/2轻微延长,但这些差异不具有临床意义。
处理:合用时无需调整剂量。
5.抗糖尿病药:
结果:喹诺酮类药与抗糖尿病药合用可能引起血糖紊乱(包括高血糖症和低血糖症)。
处理:合用时应密切监测血糖。
6.华法林:
结果:在健康受试者中进行的临床试验表明,本药对R-和S-华法林的Cmax、AUC和其他代谢参数无明显影响。同样,华法林对本药
的吸收和代谢亦无明显影响。但上市后有本药使华法林作用增强的报道。
处理:合用时应密切监测凝血酶原时间、INR或进行其他适宜的抗凝试验,还应监测是否有出血的迹象。
7.茶碱:
结果:在健康受试者中进行的临床试验表明,本药对茶碱的血浆浓度、AUC和其他代谢参数无明显影响。同样,茶碱对本药的吸收和
代谢亦无明显影响。但患者合用其他氟喹诺酮类药和茶碱可导致茶碱血浆浓度升高、t1/2延长,从而增加茶碱相关不良反应的发生
率。此外,无论茶碱的血药浓度是否升高均有可能出现不良反应(包括癫痫发作)。
处理:合用时应密切监测茶碱水平,并进行适当的剂量调整。
8.含铝或镁的抗酸药、硫糖铝、金属离子制剂(如铁剂)、含锌的多种维生素制剂、去羟肌苷:
结果:合用可干扰本药口服制剂的胃肠道吸收,导致本药的全身药物浓度显著低于预期浓度。
处理:以上药物应于口服本药前或后至少2小时服用。
9.地高辛:
结果:在健康受试者中进行的临床试验表明,本药对地高辛的Cmax、AUC和其他代谢参数无明显影响。同样,地高辛对本药的吸收
和代谢亦无明显影响。
处理:合用时无需调整剂量。
10.Ⅰa类抗心律失常药(如奎尼丁、普鲁卡因胺)或Ⅲ类抗心律失常药(如胺碘酮、索他洛尔):
处理:本药可延长QT间期,使用上述药物的患者应避免使用本药。
药物-食物相互作用
食物:
结果:进食的同时口服本药片剂500mg,可使本药的tmax延迟约1小时,Cmax降低约14%。
处理:使用本药口服制剂时可不考虑进食的影响,建议在进食前1小时或进食后2小时服用。
【注意事项】
用药警示
1.获得细菌培养和药敏试验结果前可先使用本药进行治疗,获得检查结果后再选择适当的治疗方案。
2.使用本药口服制剂和注射剂的患者应补充充足的水分,以防止尿中药物浓度过高。
3.使用本药的患者应避免过度暴露于光源下。
4.本药滴耳液一般适用于中耳炎局限在中耳黏膜部位的局部治疗。若炎症已漫及鼓室周围,除局部治疗外,应同时服用口服制剂。
不良反应的处理方法
1.若出现肌腱疼痛、肿胀、炎症或断裂,应停药。出现肌腱炎或肌腱断裂的迹象后,建议患者休息,并换用非喹诺酮类药。
2.若出现黄疸、皮疹或其他过敏症状,应停药,必要时可采取输氧、静脉补液、给予抗组胺药、静脉注射类固醇、气道管理(包括插管)
等措施。若出现严重过敏,需给予肾上腺素。
3.若出现中枢神经系统症状(包括焦躁、躁动、意识模糊、妄想、激动、失眠、焦虑、噩梦、偏执狂、头晕、错乱、震颤、幻觉、抑
郁、自杀想法或行为),应停药,并采取适当措施。
4.若出现周围神经病症状,应立即停药。
5.若出现腹泻,应考虑是否为CDAD。若疑似或确诊为CDAD,可能需停用非针对艰难梭菌的抗生素,根据需要补充适当的液体、电
解质、蛋白质,给予针对艰难梭菌的抗生素,并进行手术(如结肠切除术)评估。
6.若出现肝炎的症状和体征,应立即停药。
7.若出现低血糖症,应立即停药,并采取适当的治疗措施。
8.若出现光敏感性、光毒性,应停药。
药物对检验值或诊断的影响
本药可导致以免疫检测试剂盒筛查尿中阿片类药的结果呈假阳性。
用药前后及用药时应当检查或监测
1.用药前应进行细菌培养和药敏试验以分离鉴定病原菌,确定其对本药的敏感性。用药期间定期进行以确定病原菌对本药是否持续敏
感,并及时发现耐药性。
2.用药期间定期监测肝肾功能、造血系统功能。
3.氟喹诺酮类药可引起血糖紊乱,且多发生于合用口服降糖药或胰岛素的糖尿病患者,故此类患者用药期间应密切监测血糖。
【药物过量】
过量的表现
喹诺酮类药过量可出现恶心、呕吐、胃痛、胃灼热、腹泻、口渴、口腔炎、蹒跚、头晕、头痛、全身倦怠、麻木感、发冷、发热、 锥体外系症状、兴奋、幻觉、抽搐、谵妄、共济失调、颅内压升高(表现为头痛、呕吐、视神经乳头水肿)、代谢性酸中毒、血糖升高、丙氨酸氨基转移酶升高、天门冬氨酸氨基转移酶升高、碱性磷酸酶升高、白细胞减少、嗜酸粒细胞增多、血小板减少、溶血性贫血、血尿、软骨或关节疾病、白内障、视力障碍、色觉异常、复视。
过量的处理
1.本药急性口服过量时应洗胃,观察患者并给予水、电解质支持疗法。
2.本药过量时的急救措施和解毒药:
(1)输液(加保肝药物):出现代谢性酸中毒时给予碳酸氢钠注射液;给予碳酸氢钠注射液还可碱化 尿液,以增加本药经肾脏的排泄量。(2)强制利尿:给予呋塞米注射液。(3)对症治疗:出现抽搐时反复静脉给予地西泮注射液。
3.血液透析和腹膜透析不能有效地清除本药。
【药理】
药效学
本药为氧氟沙星的左旋体,属氟喹诺酮类抗菌药。
·作用机制 抑制细菌DNA复制、转录、修复和重组所需的拓朴异构酶Ⅳ和DNA旋转酶(拓朴异构酶Ⅱ)。
·抗菌谱 体外试验和临床试验表明本药对以下微生物有抗菌活性:
(1)革兰阳性需氧菌:粪肠球菌(多种菌株仅中度敏感)、金黄色葡萄 球菌(甲氧西林敏感菌株)、表皮葡萄球菌(甲氧西林敏感菌株)、腐生葡萄球菌、肺炎链球菌(包括多重耐药性菌株)、化脓性链球菌、炭疽杆菌。
(2)革兰阴性需氧菌:阴沟肠杆菌、大肠埃希菌、流感嗜血杆菌、副流感嗜血杆菌、肺炎克雷伯杆菌、肺炎军团菌、卡他莫拉
菌、奇异变形杆菌、铜绿假单胞菌、粘质沙雷菌。
(3)其他微生物:肺炎衣原体、肺炎支原体。
药动学
本药口服后吸收迅速而完全,
tmax为1-2小时,本药500mg和750mg片剂的绝对生物利用度约为99%。分别单次静脉给予健康受试者本药500mg(滴注时间>60分钟)和750mg(滴注时间>90分钟),Cmax分别为(6.2±1.0)μg/ml和(11.5±4.0)μg/ml。单次及多次口服或注射给予本药后,药代动力学呈线性。口服本药一次500mg或750mg、一日1次,48小时后达稳态。口服本药一次500mg、 一日1次,多次给药后Cmax和血药谷浓度(Cmin)分别为(5.7±1.4)μg/ml和(0.5±0.2)μg/ml;口服本药一次750mg、一日1次,多次给药后Cmax和Cmin分别为(8.6±1.9)μg/ml和(1.1±0.4)μg/ml。静脉滴注本药一次500mg、一日1次,多次给药后Cmax和Cmin分别为(6.4±0.8)μg/ml和(0.6±0.2)μg/ml;静脉滴注本药一次750mg、一日1次,多次给药后Cmax和Cmin分别为(12.1±4.1)μg/ml和 (1.3±0.71)μg/ml。本药口服和静脉滴注给药的AUC相似,故两种给药途径可相互替代。
给予健康成人本药0.488%的滴眼液一次2滴、一日4次、连用2周,最后一次滴眼后1小时的血药浓度低于定量限0.01μg/ml。
单次或多次给予本药500mg或750mg,平均分布容积为74-112L,表明本药分布广泛。健康受试者在给药后约3小时皮肤和体液中
的药物浓度达峰值。健康受试者口服本药一次500mg和750mg、一日1次,多次给药后皮肤与血浆AUC比约为2,体液与血浆AUC比
约为1。本药对肺组织的透过性较好,单次口服本药500mg,24小时后肺中药物浓度为血浆浓度的2-5倍,浓度范围为2.4-11.3μg/
g。在本药临床相应的血浆浓度范围(1-10μg/ml)内,以平衡透析法测得体外本药与血浆蛋白的结合率为24%-38%。在人类,本药主
要与血清白蛋白结合,且结合率与药物浓度无关。
本药在血浆和尿液中的立体化学结构稳定,不会代谢为其旋光异构体(D-氧氟沙星)。本药的代谢量极低,主要以原形药物随尿液排泄。口服给药后,约87%的药物在48小时内以原形药物随尿液排泄,少于4%的药物在72小时内随粪便排泄。少于5%的药物以去甲基代谢产物及N-氧化代谢产物的形式随尿液排泄,这是人体中仅有的两种代谢产物,其药理活性极低。平均表观清除率和肾脏清除率分别为144-226ml/min和96-142ml/min。肾脏清除率超过肾小球滤过率表明本药不仅经肾小球滤过,而且可经肾小管分泌。单次或多次口服或静脉给药后,平均血浆终末半衰期为6-8小时。
单次静脉给予6个月至16岁儿童本药7mg/kg,可见本药在儿童体内的清除较成人快,导致相应剂量下暴露量偏低。给予6个月至17岁儿童本药一次8mg/kg(不超过250mg)、每12小时1次即可使血浆暴露量(Cmax、AUC0-24)达稳态,而成人需一次500mg、每24小时1次方可使血浆暴露量达稳态。 在考虑肌酐清除率差异的情况下,老年受试者与年轻受试者用药后的药动学无显著差异。
在肾功能损害(肌酐清除率<50ml/min)者体内,本药的清除率显著降低,血浆消除半衰期明显延长。
遗传、生殖毒性与致癌性
·遗传毒性 (1)在Ames试验、CH0/HGPRT正向突变试验、小鼠微核试验、小鼠显性致死试验、大鼠程序外DNA合成试验(UDS)、小
鼠姐妹染色单体交换试验中,本药未表现出致突变性。(2)本药的体外中国仓鼠肺细胞(CHL细胞)染色体畸变试验、CHL/IU细胞姐妹染
色单体交换试验结果呈阳性。
·生殖毒性 (1)分别口饲和静脉给予大鼠本药一日360mg/kg和一日100mg/kg(以体表面积计,分别为人类推荐最大剂量750mg的4.2
倍和1.2倍),未见对生育力有损害。(2)分别口饲和静脉给予大鼠本药一日810mg/kg和一日160mg/kg(以体表面积计,分别为人类推
荐最大剂量的9.4倍和1.9倍),未见致畸性,但口饲给予一日810mg/kg剂量组可见胎仔体重降低和胎仔死亡率增加。(3)分别口饲和静
脉给予兔本药一日50mg/kg和一日25mg/kg(以体表面积计,分别为人类推荐最大剂量的1.1倍和0.5倍),未见致畸性。
·致癌性 (1)掺食给予大鼠本药最高达一日100mg/kg(以体表面积计,为人类推荐最大剂量的1.4倍),连用2年,终身进行生物检定,
未见致癌性。(2)在与光照的联合致癌性研究中,未见本药缩短紫外线诱导无毛小鼠(Skh-1)出现皮肤肿瘤的时间。在该试验中,给予
最高试验剂量一日300mg/kg时,无毛小鼠的皮肤药物浓度为25-42μg/g,而人类给予最大剂量750mg且达Cmax时的皮肤药物浓度
约为11.8μg/g。
【制剂与规格】
左氧氟沙星片 (1)100mg。(2)250mg。(3)500mg。
注射用左氧氟沙星 (1)200mg。(2)300mg。
左氧氟沙星注射液 (1)2ml:200mg。(2)5ml:300mg。(3)5ml:500mg。(4)10ml:500mg。
左氧氟沙星氯化钠注射液 (1)100ml(左氧氟沙星300mg、氯化钠0.950g)。(2)100ml(左氧氟沙星500mg、氯化钠0.9g)。
左氧氟沙星滴眼液 0.488%。
盐酸左氧氟沙星片(以左氧氟沙星计) (1)100mg。(2)200mg。(3)250mg。(4)500mg。(5)750mg。
盐酸左氧氟沙星分散片(以左氧氟沙星计) 100mg。
盐酸左氧氟沙星胶囊(以左氧氟沙星计) (1)100mg。(2)200mg。(3)250mg。
注射用盐酸左氧氟沙星(以左氧氟沙星计) (1)100mg。(2)200mg。(3)300mg。(4)400mg。(5)500mg。
盐酸左氧氟沙星注射液(以左氧氟沙星计) (1)1ml:100mg。(2)2ml:50mg。(3)2ml:100mg。(4)2ml:200mg。(5)3ml:300mg。(6)52022/7/14
左氧氟沙星
http://172.16.2.101:10000/content/html/print.htm?randnumber=0.7572357701254799
9/12
ml:100mg。(7)5ml:200mg。(8)5ml:250mg。(9)5ml:300mg。(10)5ml:400mg。(11)5ml:500mg。(12)10ml:100mg。(13)10ml:
300mg。
盐酸左氧氟沙星葡萄糖注射液 (1)100ml(左氧氟沙星100mg、葡萄糖5g)。(2)100ml(左氧氟沙星200mg、葡萄糖5g)。
盐酸左氧氟沙星氯化钠注射液 (1)50ml(左氧氟沙星200mg、氯化钠0.45g)。(2)100ml(左氧氟沙星100mg、氯化钠0.9g)。(3)100ml
(左氧氟沙星200mg、氯化钠0.9g)。(4)100ml(左氧氟沙星250mg、氯化钠0.9g)。(5)100ml(左氧氟沙星300mg、氯化钠0.86g)。(6)
100ml(左氧氟沙星300mg、氯化钠0.9g)。(7)100ml(左氧氟沙星400mg、氯化钠0.9g)。(8)100ml(左氧氟沙星500mg、氯化钠0.9
g)。(9)200ml(左氧氟沙星200mg、氯化钠1.8g)。(10)200ml(左氧氟沙星300mg、氯化钠1.8g)。(11)250ml(左氧氟沙星500mg、
氯化钠2.25g)。(12)250ml(左氧氟沙星750mg、氯化钠2.25g)。
盐酸左氧氟沙星眼用凝胶(以左氧氟沙星计) 0.3%。
盐酸左氧氟沙星滴眼液(以左氧氟沙星计) (1)0.3%。(2)0.488%。
盐酸左氧氟沙星滴耳液(以左氧氟沙星计) 0.5%。
盐酸左氧氟沙星乳膏(以左氧氟沙星计) 0.3%。
乳酸左氧氟沙星片(以左氧氟沙星计) (1)100mg。(2)200mg。(3)500mg。
乳酸左氧氟沙星分散片(以左氧氟沙星计) (1)100mg。(2)200mg。
乳酸左氧氟沙星胶囊(以左氧氟沙星计) 100mg。
注射用乳酸左氧氟沙星(以左氧氟沙星计) (1)100mg。(2)200mg。(3)250mg。(4)300mg。(5)500mg。
乳酸左氧氟沙星注射液(以左氧氟沙星计) (1)2ml:100mg。(2)2ml:200mg。(3)5ml:300mg。(4)5ml:500mg。
乳酸左氧氟沙星葡萄糖注射液 (1)100ml(左氧氟沙星100mg、葡萄糖5g)。(2)100ml(左氧氟沙星200mg、葡萄糖5g)。(3)100ml(左
氧氟沙星300mg、葡萄糖5g)。
乳酸左氧氟沙星氯化钠注射液 (1)100ml(左氧氟沙星100mg、氯化钠0.9g)。(2)100ml(左氧氟沙星200mg、氯化钠0.9g)。(3)100ml
(左氧氟沙星250mg、氯化钠0.9g)。(4)100ml(左氧氟沙星300mg、氯化钠0.9g)。(5)100ml(左氧氟沙星400mg、氯化钠0.9g)。(6)1
00ml(左氧氟沙星500mg、氯化钠0.9g)。(7)200ml(左氧氟沙星200mg、氯化钠1.8g)。(8)250ml(左氧氟沙星500mg、氯化钠2.25
g)。
乳酸左氧氟沙星滴眼液(以左氧氟沙星计) 0.3%。
甲磺酸左氧氟沙星片(以左氧氟沙星计) 100mg。
甲磺酸左氧氟沙星胶囊(以左氧氟沙星计) 100mg。
注射用甲磺酸左氧氟沙星(以左氧氟沙星计) (1)100mg。(2)200mg。(3)300mg。(4)400mg。(5)500mg。
甲磺酸左氧氟沙星注射液(以左氧氟沙星计) (1)2ml:100mg。(2)2ml:200mg。(3)2ml:300mg。(4)5ml:500mg。
甲磺酸左氧氟沙星氯化钠注射液 (1)100ml(左氧氟沙星200mg、氯化钠0.9g)。(2)100ml(左氧氟沙星300mg、氯化钠0.9g)。(3)100
ml(左氧氟沙星500mg、氯化钠0.9g)。
【贮藏】
片剂:遮光,密封保存。
分散片:遮光、密封,10-30℃保存。
胶囊:遮光,密封保存。
粉针剂:遮光,密封保存。
注射液:遮光、密封保存。
眼用凝胶:遮光、密封,在阴凉处(不超过20℃)保存。
滴眼液:遮光、密封,室温(10-30℃)保存。
滴耳液:遮光,密封保存。
乳膏:遮光、密封,在阴凉处(不超过20℃)保存。
【参考文献】
1.药品说明书-左氧氟沙星注射液(宁波天衡药业股份有限公司)
2.药品说明书(2017-08-20)-左氧氟沙星注射液(河北智同生物制药股份有限公司)
3.药品说明书(2016-08-18)-甲磺酸左氧氟沙星氯化钠注射液(华润双鹤药业股份有限公司)
4.药品说明书(2020-10-27)-左氧氟沙星片(浙江莎普爱思药业股份有限公司)
5.药品说明书(2020-08-05)-左氧氟沙星片[第一三共制药(北京)有限公司]
6.药品说明书(2017-09-01)-左氧氟沙星氯化钠注射液[第一三共制药(北京)有限公司]
7.药品说明书(2012-12-11)-左氧氟沙星氯化钠注射液[第一三共制药(北京)有限公司]2022/7/14
左氧氟沙星
http://172.16.2.101:10000/content/html/print.htm?randnumber=0.7572357701254799
10/12
8.药品说明书(2020-09-16)-左氧氟沙星滴眼液(扬子江药业集团有限公司)
9.药品说明书-注射用左氧氟沙星[正安医药(四川)有限公司]
10.国家药品监督管理局.国家药监局关于修订全身用氟喹诺酮类药品说明书的公告(2021年第44号).URL:https://www.nmpa.gov.cn/x
xgk/ggtg/ypshmshxdgg/20210323110517152.html, 2021-03-23
11.药品说明书(2018-02-02)-注射用盐酸左氧氟沙星(山西威奇达光明制药有限公司)
12.药品说明书(2018-02-07)-盐酸左氧氟沙星氯化钠注射液(扬子江药业集团有限公司)
13.药品说明书-注射用乳酸左氧氟沙星(扬州奥赛康药业有限公司)
14.药品说明书-注射用乳酸左氧氟沙星(南京长澳制药有限公司)
15.药品说明书(2017-09-01)-注射用甲磺酸左氧氟沙星(湖南五洲通药业有限责任公司)
16.药品说明书(2007-07-21)-注射用甲磺酸左氧氟沙星(北京四环科宝制药有限公司)
17.药品说明书(2007-05-11)-注射用甲磺酸左氧氟沙星(浙江杭康药业有限公司)
18.药品说明书(2013-03-07)-盐酸左氧氟沙星注射液(辰欣药业股份有限公司)
19.药品说明书(2020-03-16)-盐酸左氧氟沙星胶囊(珠海联邦制药股份有限公司中山分公司)
20.药品说明书(2011-10-20)-盐酸左氧氟沙星注射液(苏州长征-欣凯制药有限公司)
21.药品说明书(2011-08-03)-盐酸左氧氟沙星注射液(白求恩医科大学制药厂)
22.药品说明书(2009-06-19)-盐酸左氧氟沙星注射液(浙江康恩贝制药股份有限公司)
23.药品说明书(2006-08-15)-盐酸左氧氟沙星注射液(山西亚宝药业集团股份有限公司)
24.药品说明书-盐酸左氧氟沙星注射液(山西普德药业有限公司)
25.药品说明书(2019-05-29)-盐酸左氧氟沙星注射液(扬子江药业集团有限公司)
26.FDALabel(2017-02-08)-LEVAQUIN(Levofloxacin Tablet, Oral Solution, Injection)(Janssen Pharmaceuticals, Inc.)
27.药品说明书-盐酸左氧氟沙星注射液(浙江医药股份有限公司新昌制药厂)
28.药品说明书(2017-07-10)-盐酸左氧氟沙星眼用凝胶(湖北远大天天明制药有限公司)
29.药品说明书(2015-11-07)-盐酸左氧氟沙星乳膏(珠海联邦制药股份有限公司中山分公司)
30.药品说明书(2019-10-25)-左氧氟沙星片(广东东阳光药业有限公司)
31.药品说明书(2007-06-22)-盐酸左氧氟沙星葡萄糖注射液(金陵药业股份有限公司浙江天峰制药厂)
32.药品说明书-盐酸左氧氟沙星葡萄糖注射液(江苏苏中制药厂)
33.药品说明书(2019-12-01)-盐酸左氧氟沙星片(四川科伦药业股份有限公司)
34.药品说明书(2018-08-14)-盐酸左氧氟沙星片(山东罗欣药业集团股份有限公司)
35.药品说明书(2017-09-26)-盐酸左氧氟沙星片(山东鲁抗医药集团赛特有限责任公司)
36.药品说明书(2019-12-01)-盐酸左氧氟沙星氯化钠注射液(四川科伦药业股份有限公司)
37.药品说明书-甲磺酸左氧氟沙星胶囊(河南天方药业股份有限公司)
38.药品说明书(2012-12-31)-盐酸左氧氟沙星氯化钠注射液(海南华拓天涯制药有限公司)
39.药品说明书(2017-11-06)-盐酸左氧氟沙星胶囊(广东逸舒制药股份有限公司)
40.药品说明书(2019-01-22)-盐酸左氧氟沙星胶囊(海口奇力制药股份有限公司)
41.药品说明书(2017-09-08)-盐酸左氧氟沙星氯化钠注射液(山东齐都药业有限公司)
42.药品说明书(2007-03-13)-盐酸左氧氟沙星分散片(山东健康药业有限公司)
43.药品说明书(2019-05-08)-盐酸左氧氟沙星滴眼液(广东宏盈科技有限公司)
44.药品说明书(2019-07-30)-盐酸左氧氟沙星滴眼液(宁夏康亚药业股份有限公司)
45.药品说明书(2019-08-20)-盐酸左氧氟沙星滴耳液(深圳万和制药有限公司)
46.药品说明书(2007-05-19)-乳酸左氧氟沙星注射液(江苏涟水制药有限公司)
47.药品说明书(2017-11-01)-甲磺酸左氧氟沙星片(华润双鹤药业股份有限公司)
48.药品说明书(2015-08-18)-甲磺酸左氧氟沙星注射液(成都倍特药业有限公司)
49.药品说明书-甲磺酸左氧氟沙星注射液(河南天方药业股份有限公司)
50.药品说明书(2017-06-23)-乳酸左氧氟沙星滴眼液(杭州国光药业股份有限公司)
51.药品说明书-乳酸左氧氟沙星注射液(江苏涟水制药有限公司)
52.药品说明书(2007-05-31)-乳酸左氧氟沙星葡萄糖注射液(浙江康吉尔药业有限公司)
53.药品说明书(2019-06-11)-乳酸左氧氟沙星氯化钠注射液(浙江医药股份有限公司新昌制药厂)
54.药品说明书-乳酸左氧氟沙星葡萄糖注射液(山西云中制药有限责任公司)
55.药品说明书(2018-03-07)-盐酸左氧氟沙星氯化钠注射液(山东齐都药业有限公司)2022/7/14
左氧氟沙星
http://172.16.2.101:10000/content/html/print.htm?randnumber=0.7572357701254799
11/12
56.药品说明书(2019-06-17)-乳酸左氧氟沙星片(浙江医药股份有限公司新昌制药厂)
57.药品说明书(2015-10-10)-乳酸左氧氟沙星片(河北天成药业股份有限公司)
58.药品说明书-乳酸左氧氟沙星片(上海三维制药有限公司)
59.药品说明书(2019-12-01)-乳酸左氧氟沙星氯化钠注射液(信合援生制药股份有限公司)
60.药品说明书(2018-01-15)-乳酸左氧氟沙星氯化钠注射液[华夏生生药业(北京)有限公司]
61.药品说明书(2017-09-29)-乳酸左氧氟沙星氯化钠注射液(辽宁海神联盛制药有限公司)
62.药品说明书-乳酸左氧氟沙星氯化钠注射液(湖南科伦制药有限公司)
63.药品说明书(2016-08-16)-乳酸左氧氟沙星胶囊(江西汇仁药业股份有限公司)
64.药品说明书(2017-08-22)-乳酸左氧氟沙星分散片(海南全星制药有限公司)
65. World Health Organization. Companion handbook to the WHO guidelines for the programmatic management of drug
-resistant tuberculosis. WHO/HTM/TB/2014. 11. Geneva: World Health Organization, 2014.
66.Bacci C, Galli L, de Martino M, et al. Fluoroquinolones in children: update of the literatiare[J]. J Chemothier, 2015, 27
(5): 257-265.
67.Baddour LM, Harper M. Animal bites (dogs, cats, and other animals): evaluation and management. Post TW, ed. UpToD
ate. Waltham, MA: UpToDate Inc. http://www.uptodate.com. Accessed October 18, 2019a.
68.Baddour LM, Harper M. Human bites: evaluation and management. Post TW, ed. UpToDate. Waltham, MA: UpToDate I
nc. http://www.uptodate.com. Accessed October 18, 2019b.
69.Bratzler DW, Dellinger EP, Olsen KM, et al, “Clinical Practice Guidelines for Antimicrobial Prophylaxis in Surgery,” Surg I
nfect (Larchmt), 2013, 14(1):73-156.
70.Bucaneve G, Micozzi A, Menichetti F, et al; Gruppo Italiano Malattie Ematologiche dell’Adulto (GIMEMA) Infection Pro
gram. Levofloxacin to prevent bacterial infection in patients with cancer and neutropenia. N Engl J Med. 2005;353(10):977-
987.
71.Cullen M, Steven N, Billingham L, et al; Simple Investigation in Neutropenic Individuals of the Frequency of Infection aft
er Chemotherapy +/- Antibiotic in a Number of Tumours (SIGNIFICANT) Trial Group . Antibacterial prophylaxis after chem
otherapy for solid tumors and lymphomas. N Engl J Med. 2005;353(10):988-998.
72.Eyre RC. Evaluation of acute scrotal pain in adults. Post TW, ed. UpToDate. Waltham, MA: UpToDate Inc. http://www.up
todate.com. Accessed October 21, 2019.
73.Freifeld AG, Bow EJ, Sepkowitz KA, et al; Infectious Diseases Society of America. Clinical practice guideline for the use o
f antimicrobial agents in neutropenic patients with cancer: 2010 update by the Infectious Diseases Society of America. Cli
n Infect Dis. 2011;52(4):e56-e93.
74.Lee SSF, Fulford AE, Quinn MA, Seabrook J, Rajakumar I. Levofloxacin for febrile neutropenia prophylaxis in acute myel
oid leukemia patients associated with reduction in hospital admissions. Support Care Cancer. 2018b;26(5):1499-1504.
75.Lieberthal AS, Carroll AE, Chonmaitree T, et al. The diagnosis and management of acute otitis media[J]. Pediatrics, 201
3, 131(3): e964-e999.
76.Marrazzo J. Treatment of Chlamydia trachomatis infection. Post TW, ed. UpToDate. Waltham, MA: UpToDate Inc. htt
p://www.uptodate.com. Accessed August 9, 2018.
77.Nahid P, Dorman SE, Alipanah N, et al. Official American Thoracic Society/Centers for Disease Control and Prevention/I
nfectious Diseases Society of America clinical practice guidelines: treatment of drug-susceptible tuberculosis. Clin Infect D
is. 2016;63(7):e147-e195.
78.Riddle MS, Connor BA, Beeching NJ, et al. Guidelines for the prevention and treatment of travelers’ diarrhea: a grade
d expert panel report. J Travel Med. 2017;24(suppl 1):S57-S74.
79.Riddle MS, DuPont HL, Connor BA. ACG clinical guideline: diagnosis, treatment, and prevention of acute diarrheal infec
tions in adults. Am J Gastroenterol. 2016;111(5):602-622.
80.Schluger NW, Heysell SK, Friedland G. Treatment of drug-resistant pulmonary tuberculosis in adults. Post TW, ed. UpTo
Date. Waltham, MA: UpToDate Inc. http://www.uptodate.com. Accessed October 21, 2019.
81.Stevens DL, Bisno AL, Chambers HF, et al. Practice guidelines for the diagnosis and management of skin and soft tissu
e infections: 2014 update by the Infectious Diseases Society of America [published online ahead of print June 18, 2014]. Cl
in Infect Dis. 2014;59(2):e10-e52.
82.Tomblyn M, Chiller T, Einsele H, et al; Center for International Blood and Marrow Research; National Marrow Donor pro2022/7/14
左氧氟沙星
http://172.16.2.101:10000/content/html/print.htm?randnumber=0.7572357701254799
12/12
gram; European Blood and Marrow Transplant Group; et al. Guidelines for preventing infectious complications among he
matopoietic cell transplantation recipients: a global perspective [published correction appears in Biol Blood Marrow Trans
plant. 2010;16(2):294]. Biol Blood Marrow Transplant. 2009;15(10):1143-1238.
83.Wiesenfeld HC. Pelvic inflammatory disease: Treatment in adults and adolescents. Post TW, ed. UpToDate. Waltham, M
A: UpToDate Inc. http://www.uptodate.com. Accessed April 22, 2019.
84.Wingard JR. Prophylaxis of infection during chemotherapy-induced neutropenia in high-risk adults. Post TW, ed. UpTo
Date. Waltham, MA: UpToDate Inc. http://www.uptodate.com. Accessed October 18, 2019.
85.Workowski KA, Bolan GA; Centers for Disease Control and Prevention. Sexually transmitted diseases treatment guidelin
es, 2015 [published correction appears in MMWR Recomm Rep. 2015;64(33):924]. MMWR Recomm Rep. 2015;64(RR-03):1
-137.
86.World Health Organization. Companion handbook to the WHO guidelines for the programmatic management of drug-
resistant tuberculosis. WHO/HTM/TB/2014. 11. Geneva: World Health Organization, 2014.
87.World Health Organization. Guidelines for the programmatic management of drug-resistant tuberculosis 2011 updat
e. WHO/HTM/TB/2011. 6[M]. Geneva: World Health Organization, 2011.
88.World Health Organization. Treatment guidelines for drug-resistant tuberculosis. 2016 update. WHO/HTM/TB/2016.0
4. Geneva: World Health Organization, 2016.
89.World Health Organization. Treatment of tuberculosis: guidelines-4th ed. WHO/HTM/TB/2009. 420[M]. Geneva: Worl
d Health Organization, 2009.
90.广东省药学会.氟喹诺酮类抗菌药物在儿童应用中的专家共识
91.刘宇红, 杜建, 高微微, 等. 含链霉素或左氧氟沙星方案治疗复治肺结核患者的近期疗效及安全性[J]. 中国防痨杂志, 2015, 37(5): 487
-493. DOI: 10.3969/j.issn.1000-6621.2015.05.005.
92.罗敏、苏娜、徐珽.美国医院药师学会外科手术抗菌药物预防使用临床实践指南简介.中国医院药学杂志.2013,33(19):1638-1641.
93.慢性阻塞性肺疾病急性加重(AECOPD)诊治专家组.慢性阻塞性肺疾病急性加重(AECOPD)诊治中国专家共识(2017年更新版).国际呼
吸杂志.2017,37(14):1041-1057.
94.沙巍, 张青, 崔文玉, 等. 首次复治肺结核患者短程化疗新方案的临床研究[J]. 中国防痨杂志, 2017, 39(1): 39-45.
95.山东省药学会循证药学专业委员会. 山东省超药品说明书用药专家共识(2021年版)[J]. 临床药物治疗杂志, 2021, 19(6): 9-40.
96.亚洲干眼协会中国分会、海峡两岸医药交流协会眼科专业委员会眼表与泪液病学组.我国翼状胬肉围手术期用药专家共识(2017年).
中华眼科杂志.2017.53(9):653-656.
97.中国性学会性医学专业委员会生殖道感染学组.生殖道支原体感染诊治专家共识.中国性科学.2016,25(3):80-82.
98.中国中西医结合学会消化系统疾病专业委员会.消化性溃疡中西医结合诊疗共识意见(2017年).中国中西医结合消化杂志.2018.26(2):
112-120.
99.中华人民共和国卫生部.人粒细胞无形体病预防控制技术指南(试行)
100.中华人民共和国卫生部.鼠疫诊疗方案(试行)
101.中华医学会创伤学分会创伤感染学组、中华医学会急诊医学分会创伤学组.创伤后抗菌药物预防性应用专家共识.中华急诊医学杂
志.2016,25(10):1224-1228.
102.中华医学会肝病学分会、中华医学会消化病学分会、中华医学会内镜学分会.肝硬化门静脉高压食管胃静脉曲张出血的防治指南.临
床肝胆病杂志.2016,32(2):203-219.
103.中华医学会结核病学分会、《中华结核和呼吸杂志》编辑委员会.非结核分枝杆菌病诊断与治疗专家共识.中华结核和呼吸杂志,201
2,35(8):572-580.
104.中华医学会结核病学分会、抗结核药物超说明书用法专家共识编写组.抗结核药物超说明书用法专家共识.中华结核和呼吸杂志,201
8,41(6):447-460.
105.中华中医药学会儿童肺炎联盟.儿童肺炎支原体肺炎中西医结合诊治专家共识(2017年制定).中国实用儿科杂志.2017.32(12):881-8
85.

